Sauerstoffmangel programmiert Mitochondrien um
Forscher bremsen Wachstum von Tumorzellen der Bauchspeicheldrüse
Mitochondrien verbrennen Sauerstoff und stellen dadurch Energie für den Körper bereit. Ohne Sauerstoff oder bei Nährstoffmangel müssen Zellen schnell ihre Energieversorgung umstellen. Wissenschaftler vom Max-Planck-Institut für Biologie des Alterns haben nun in einer in Nature publizierten Studie gezeigt, dass Mitochondrien unter Sauerstoff- und Nährstoffmangel umprogrammiert werden. Auf diese Weise können die Zellen weiterwachsen. Auch Tumore der Bauchspeicheldrüse nutzen diese Umprogrammierung, und können sich so trotz wenig vorhandener Nährstoffe und Sauerstoffmangel weiter ausbreiten. Die Forscher glauben, dass Proteine in diesem neu entdeckten Signalweg ein gutes Ziel für Therapien gegen Bauchspeicheldrüsenkrebs sein könnten, gegen den es bisher kein Medikament gibt.
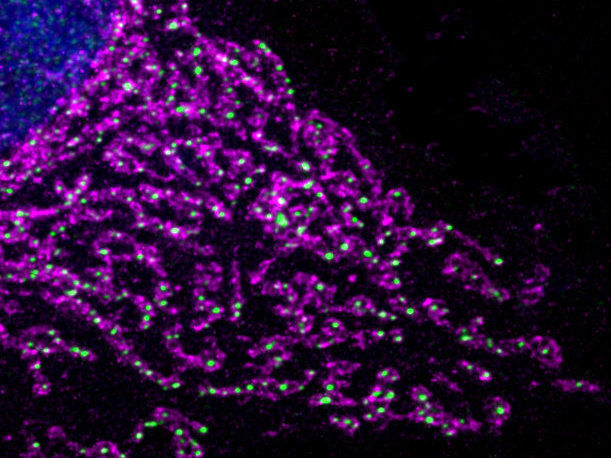
Mitochondrien formen in der Zelle große Netzwerke. Bei Sauerstoffmangel zerfällt dieses Netzwerk, die Mitochondrien werden weniger und sie werden zusätzlich umprogrammiert. (Zellkern (blau), Mitochondrien (pink), DNA (grün))
© MPI f. Biologie des Alterns/ Thomas MacVicar
Zellen stellen sich auf Sauerstoffmangel ein, indem sie ihre Energieversorgung auf die sogenannte Glykolyse umstellen, bei der Zucker ohne Sauerstoff vergärt wird. Dies kann zum Beispiel im Alter nötig sein, da die Zellen im Körper häufig schlechter mit Sauerstoff und Nährstoffen versorgt werden. Aber auch Krebszellen können dieses Problem haben, da einige Tumore schlecht durchblutet sind und so wenig Sauerstoff und Nährstoffe zu den Zellen gelangen.
„Es war schon länger bekannt, dass Zellen die Anzahl an Mitochondrien reduzieren, wenn sie bei Sauerstoffmangel auf Glykolyse umsteigen und diese nicht mehr für die Energieproduktion benötigen. Wir haben jetzt herausgefunden, dass die noch verbleibenden Mitochondrien zusätzlich umprogrammiert werden, um den neuen Anforderungen gerecht zu werden“, erklärt Max-Planck-Direktor Thomas Langer.
Umstellung mit eingebauter Zeitschaltuhr
Dieses geschieht über einen neu entdeckten Signalweg in der Zelle: Eine Protease in der Membran von Mitochondrien wird bei der Umstellung auf Glykolyse aktiviert und baut dann verschiedenste Proteine in den Organellen ab. Dadurch können keine neuen Mitochondrien mehr gebildet werden und die verbleibenden Mitochondrien ändern ihren Stoffwechsel. Dieser Prozess stoppt irgendwann von selbst, da die Protease bei hoher Aktivität anfängt sich selbst abzubauen. „Dieser Signalweg hat nicht nur eine eingebaute Zeitschaltuhr, sondern ermöglicht eine sehr schnelle Antwort auf Sauerstoffmangel“, so Langer.
Verringertes Wachstum von Tumorzellen
Die Forschenden haben dann Krebszellen untersucht, die von Patienten mit Pankreastumoren stammen. Diese Tumore wachsen unter Sauerstoffmangel und sind höchst aggressiv. Die Wissenschaftler waren in der Lage das Tumorwachstum zu verringern, wenn sie den Signalweg in den Mitochondrien abschalten. Dieses zeigte sich sowohl in Krebszellen in der Petrischale als auch bei Tumoren in der Bauchspeicheldrüse von Mäusen. „Gegen Pankreaskrebs gibt es bis jetzt keine Behandlung. Ich glaube, dass diese Protease ein sehr interessantes therapeutisches Ziel sein kann, da wir gesehen haben, dass der Signalweg auch in Patienten mit Bauspeicheldrüsenkrebs aktiv ist“, erklärt Langer. „Allerdings sind bis jetzt keine Substanzen bekannt, die auf diese Protease wirken.“
Originalveröffentlichung
Thomas MacVicar, Yohsuke Ohba, Hendrik Nolte, Fiona Carola Mayer, Takashi Tatsuta, Hans-Georg Sprenger, Barbara Lindner, Yue Zhao, Jiahui Li, Christiane Bruns, Marcus Krüger, Markus Habich, Jan Riemer, Robin Schwarzer, Manolis Pasparakis, Sinika Henschke, Jens C. Brüning, Nicola Zamboni, Thomas Langer; "Lipid signalling drives proteolytic rewiring of mitochondria by YME1L"; Nature; 6. November 2019
Meistgelesene News
Originalveröffentlichung
Thomas MacVicar, Yohsuke Ohba, Hendrik Nolte, Fiona Carola Mayer, Takashi Tatsuta, Hans-Georg Sprenger, Barbara Lindner, Yue Zhao, Jiahui Li, Christiane Bruns, Marcus Krüger, Markus Habich, Jan Riemer, Robin Schwarzer, Manolis Pasparakis, Sinika Henschke, Jens C. Brüning, Nicola Zamboni, Thomas Langer; "Lipid signalling drives proteolytic rewiring of mitochondria by YME1L"; Nature; 6. November 2019
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Genetischer Urintest: Eine neue Option in der Früherkennung des Prostatakrebses - Daten zeigen Prostatakrebs-Gen (PCA3) korreliert mit dem Schweregrad des Prostatakarzinoms

Mensch oder ChatGPT? - Unterschiede zwischen tiermedizinischen Fachartikeln schwer feststellbar

Auf Onlinelehre reagiert der Körper anders
Bone_morphogenetic_protein
Phylogenese

ABB Robotics und Mettler-Toledo bündeln ihre Kräfte, um die weltweite Einführung der flexiblen Laborautomation zu beschleunigen - Unternehmen wollen die Grenzen der Laborrobotik neu definieren, um Innovationen zu beschleunigen und den Arbeitskräftemangel zu beheben
Nicht EHEC, sondern EAHEC: Göttinger Mikrobiologen entschlüsseln Genom des Erregers - Erklärung für aggressives Verhalten
Response_Element
Frameshift
Tapetum_lucidum




















































