Nanostrukturen helfen, die Haftung von Krankenhauskeimen zu reduzieren
Wissenschaftler der Universität des Saarlandes und des Karlsruher Instituts für Technologie haben gemeinsam herausgefunden, wie Bakterien auf – in mikroskopischen Maßstäben – rauen Oberflächen haften. Das Team aus den Disziplinen Physik, Mikrobiologie und Mathematik entdeckte, dass aus der genauen Analyse der Beschaffenheit nano-strukturierter Oberflächen die Haftkraft direkt abgeleitet werden kann. Damit eröffnen sich vielversprechende neue Forschungsansätze, auch für den Kampf gegen so genannte multiresistente Keime, die vor allem in Krankenhäusern eine Gefahr darstellen.
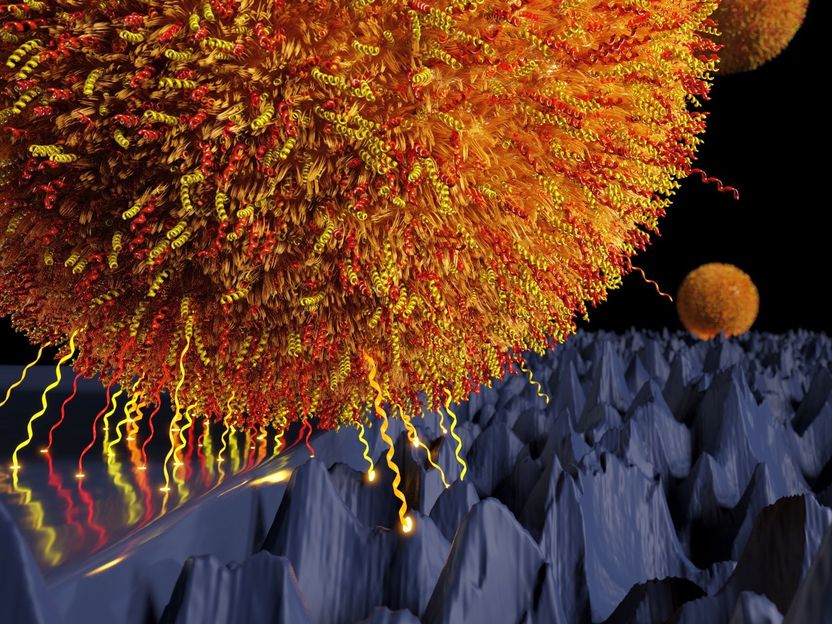
Je rauer einer Oberfläche auf Nanoebene ist, desto schlechter können Bakterien auf ihr haften.
Illustration: Thomas Faidt/AG Jacobs
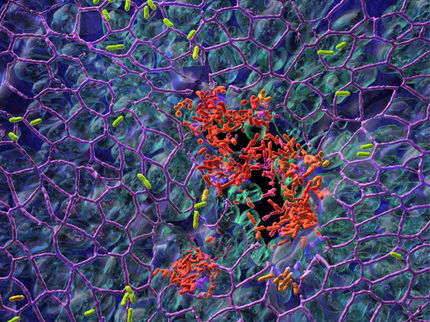
Bakterien der Art Staphylococcus aureus sind eine der Hauptursachen für im Krankenhaus erworbene Infektionen. Diese Krankheitserreger sind so gefürchtet, weil sie auf natürlichen und künstlichen Oberflächen sehr robuste Biofilme bilden können, die nur sehr schwer zu entfernen sind. Innerhalb dieses Biofilms sind die einzelnen Bakterien sehr effektiv vor verschiedenen Substanzen wie zum Beispiel Antibiotika geschützt, weshalb sie nur sehr schwer zu bekämpfen sind. Ein Ansatz zur Infektionsprävention besteht daher darin, die Bildung von Biofilmen bereits im Vorfeld zu verhindern. Dazu müssen Forscher aber zuerst die Mechanismen genau verstehen, mit denen Bakterien an verschiedenartigen Materialien haften. In der Praxis sind vor allem Oberflächen mit Topographien im Nanobereich, wie beispielsweise Türgriffe oder künstliche Implantate, weit verbreitet, deren unregelmäßige, raue Struktur einer bizarren Landschaft aus Bergen und Tälern ähnelt.
In einer früheren Studie fand das Team der Universität des Saarlandes unter der Leitung der Experimentalphysikerin Professor Karin Jacobs und des Mikrobiologen Professor Markus Bischoff heraus, dass die Bakterien an festen Oberflächen haften, indem viele einzelne Moleküle aus der Bakterienzellwand den Kontakt zur Oberfläche herstellen. Diese Moleküle schwanken temperaturbedingt in ihrer Größe; ihr Längenunterschied kann dadurch etwa 50 Nanometer umfassen.
In einer neuen Studie haben die Wissenschaftler nun untersucht, wie genau die Haftkraft der einzelnen Moleküle mit der Topographie der Oberflächen zusammenhängt, auf denen das Bakterium sich anzuhaften versucht. Dazu haben die Wissenschaftler Siliziumoberflächen mit Nanostrukturen unterschiedlicher Größe, aber in der gleichen Größenordnung wie die bindenden Zellwandmoleküle hergestellt.
Anschließend maßen sie die Kräfte, mit denen einzelne Bakterienzellen an diesen nanostrukturierten Oberflächen haften. Sie fanden in diesen Experimenten heraus, dass die Adhäsionskräfte mit zunehmender Größe der Nanostrukturen abnehmen. Parallel dazu analysierte der Mathematiker Michael A. Klatt aus Karlsruhe (jetzt an der Princeton University) die Siliziumsubstrate sehr genau und übersetzte die Oberflächentopographien in spezifische mathematische Maße, die als Minkowski-Funktionale bezeichnet werden – das Verfahren wird als „Morphometrie“ bezeichnet.
Gemeinsam zeigten die Teams, dass die experimentell gemessene Stärke der Kraft durch geometrische Parameter aus der Morphometrie erklärt werden kann. Vereinfacht gesagt: Nimmt die Rauheit der Oberfläche zu, stehen viele „Täler“ der Oberfläche nicht als Adhäsionsfläche zur Verfügung, da sie tiefer liegen als die fluktuierenden Moleküle. Somit geht die Haftkraft der Bakterien im gleichen Maße zurück.
Daraus resultiert ein wichtiges Ergebnis der Studie: Eine optimierte Nanostrukturierung kann die Adhäsion von Bakterien minimieren und damit die Wahrscheinlichkeit der Biofilmbildung verringern. Die Wissenschaftler weisen darauf hin, dass ihr Ergebnis auf verschiedene Arten von Bakterien und unterschiedliche Arten von Materialien übertragen werden kann. Die Resultate können daher helfen, neue Materialien zu entwickeln und zu modifizieren, die die Bakterienanhaftung und die Bildung von Biofilmen verhindern können.
Darüber hinaus zeigt die Studie das hohe Potenzial der Minkowski-Funktionale zur Analyse der Topographie eines breiten Spektrums von Materialien. Aufgrund dieser Anwendungsbreite erwarten die Wissenschaftler, dass die Minkowski-Funktionale als zukünftiger Goldstandard zur Beschreibung von Oberflächen genutzt werden.