Nobelpreis für Physiologie oder Medizin 2019 bekannt gegeben
Auszeichnung für Forscher aus Großbritannien und den USA
Die Nobelversammlung des Karolinska Institutet hat den Nobelpreis für Physiologie oder Medizin 2019 gemeinsam an William G. Kaelin Jr., Sir Peter J. Ratcliffe und Gregg L. Semenza für ihre Entdeckungen vergeben, wie Zellen die Sauerstoffverfügbarkeit erfassen und anpassen.
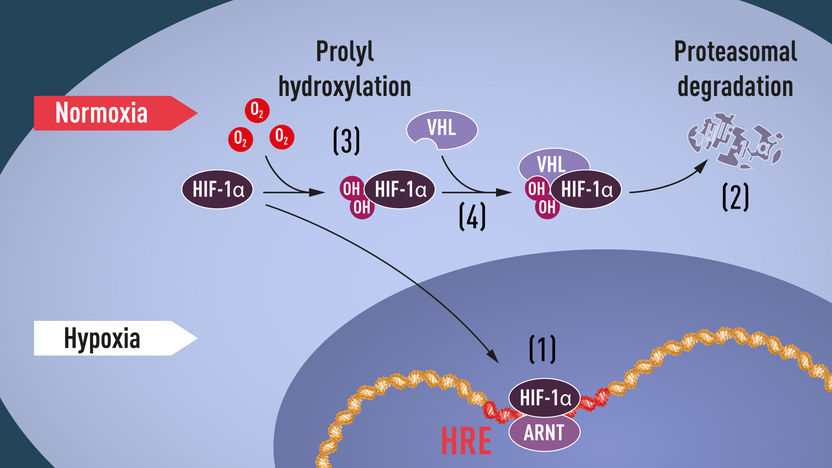
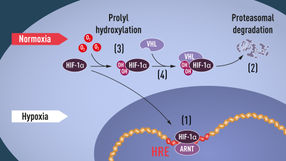
Abbildung 1: Wenn der Sauerstoffgehalt niedrig ist (Hypoxie), ist HIF-1α vor dem Abbau geschützt und sammelt sich im Kern an, wo es mit ARNT assoziiert wird und an spezifische DNA-Sequenzen (HRE) in hypoxieregulierten Genen bindet (1). Bei normalem Sauerstoffgehalt wird HIF-1α durch das Proteasom (2) schnell abgebaut. Sauerstoff reguliert den Abbauprozess durch Zugabe von Hydroxylgruppen (OH) zu HIF-1α (3). Das VHL-Protein kann dann mit HIF-1α einen Komplex erkennen und bilden, der zu dessen sauerstoffabhängigem Abbau führt (4).
© The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
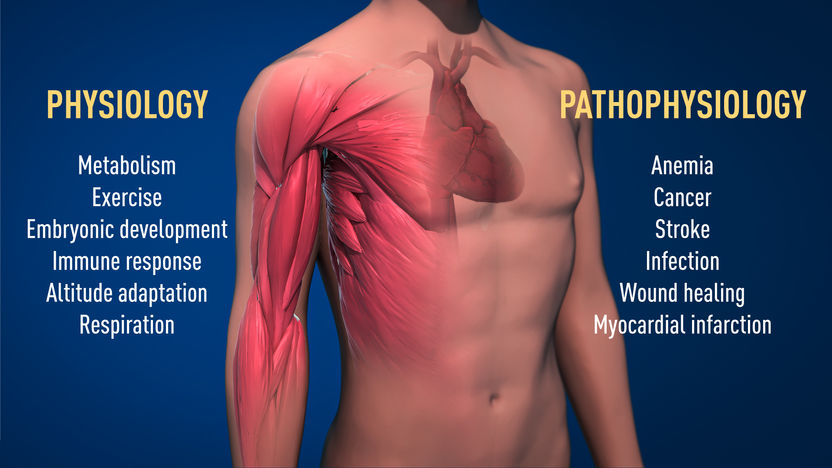
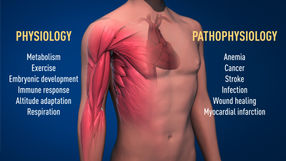
Abbildung 2: Der ausgezeichnete Mechanismus für die Sauerstoffsensorik hat in der Physiologie eine grundlegende Bedeutung, zum Beispiel für unseren Stoffwechsel, unsere Immunantwort und unsere Anpassungsfähigkeit an das Training. Viele pathologische Prozesse sind ebenfalls betroffen. Es werden intensive Anstrengungen unternommen, um neue Medikamente zu entwickeln, die die sauerstoffregulierten Maschinen zur Behandlung von Anämie, Krebs und anderen Krankheiten entweder hemmen oder aktivieren können.
© The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
Tiere benötigen Sauerstoff für die Umwandlung von Nahrung in nutzbare Energie. Die grundlegende Bedeutung von Sauerstoff wird seit Jahrhunderten verstanden, aber wie sich die Zellen an Veränderungen im Sauerstoffgehalt anpassen, war lange Zeit unbekannt.
William G. Kaelin Jr., Sir Peter J. Ratcliffe und Gregg L. Semenza entdeckten, wie Zellen die veränderte Sauerstoffverfügbarkeit erfassen und anpassen können. Sie identifizierten molekulare Mechanismen, die die Aktivität von Genen als Reaktion auf unterschiedliche Sauerstoffwerte regulieren.
Die bahnbrechenden Entdeckungen der diesjährigen Nobelpreisträger zeigten den Mechanismus für einen der wichtigsten Anpassungsprozesse des Lebens. Sie bildeten die Grundlage für unser Verständnis davon, wie sich der Sauerstoffgehalt auf den Zellstoffwechsel und die physiologische Funktion auswirkt. Ihre Entdeckungen haben auch den Weg für vielversprechende neue Strategien zur Bekämpfung von Anämie, Krebs und vielen anderen Krankheiten geebnet.
Sauerstoff im Mittelpunkt
Sauerstoff mit der Formel O2 macht etwa ein Fünftel der Erdatmosphäre aus. Sauerstoff ist für die Tierwelt unerlässlich: Er wird von den in nahezu allen tierischen Zellen vorkommenden Mitochondrien genutzt, um Nahrung in nützliche Energie umzuwandeln. Otto Warburg, der 1931 den Nobelpreis für Physiologie oder Medizin erhielt, entdeckte, dass es sich bei dieser Umwandlung um einen enzymatischen Prozess handelt.
Während der Evolution entwickelten sich Mechanismen, um eine ausreichende Sauerstoffversorgung von Geweben und Zellen zu gewährleisten. Der Carotis-Körper, angrenzend an große Blutgefäße auf beiden Seiten des Halses, enthält spezialisierte Zellen, die den Sauerstoffgehalt des Blutes erfassen. Der Nobelpreis für Physiologie oder Medizin 1938 an Corneille Heymans zeichnete Entdeckungen aus, die zeigen, wie die Sauerstoffmessung im Blut über den Karotis-Körper unsere Atemfrequenz kontrolliert, indem er direkt mit dem Gehirn kommuniziert.
HIF tritt in Erscheinung
Neben der schnellen Anpassung an einen niedrigen Sauerstoffgehalt (Hypoxie) durch den Carotis-Körper gibt es weitere grundlegende physiologische Anpassungen. Eine wichtige physiologische Reaktion auf Hypoxie ist der Anstieg des Hormons Erythropoietin (EPO), der zu einer erhöhten Produktion von roten Blutkörperchen (Erythropoese) führt. Die Bedeutung der hormonellen Kontrolle der Erythropoese war bereits zu Beginn des 20. Jahrhunderts bekannt, aber wie dieser Prozess selbst durch O2 gesteuert wurde, blieb ein Geheimnis.
Gregg Semenza untersuchte das EPO-Gen und wie es durch unterschiedliche Sauerstoffwerte reguliert wird. Durch die Verwendung genmodifizierter Mäuse konnten spezifische DNA-Segmente, die sich neben dem EPO-Gen befinden, gezeigt werden, die die Reaktion auf Hypoxie vermitteln. Sir Peter Ratcliffe untersuchte auch die O2-abhängige Regulation des EPO-Gens, und beide Forschungsgruppen fanden heraus, dass der Sauerstoffsensormechanismus in praktisch allen Geweben vorhanden ist und nicht nur in den Nierenzellen, in denen EPO normalerweise produziert wird. Dies waren wichtige Ergebnisse, die zeigten, dass der Mechanismus bei vielen verschiedenen Zelltypen allgemein und funktionell war.
Semenza wollte die zellulären Komponenten identifizieren, die diese Reaktion vermitteln. In kultivierten Leberzellen entdeckte er einen Proteinkomplex, der sauerstoffabhängig an das identifizierte DNA-Segment bindet. Er nannte diesen Komplex den Hypoxia Inducible Factor (HIF). Umfangreiche Anstrengungen zur Reinigung des HIF-Komplexes begannen, und 1995 konnte Semenza einige seiner wichtigsten Ergebnisse veröffentlichen, darunter die Identifizierung der Gene, die für HIF kodieren. Es wurde festgestellt, dass HIF aus zwei verschiedenen DNA-bindenden Proteinen besteht, den so genannten Transkriptionsfaktoren, die heute HIF-1α und ARNT heißen. Jetzt konnten die Forscher mit der Lösung des Rätsels beginnen, so dass sie verstehen konnten, welche zusätzlichen Komponenten beteiligt waren und wie die Maschine funktioniert.
VHL: ein unerwarteter Partner
Wenn der Sauerstoffgehalt hoch ist, enthalten die Zellen nur sehr wenig HIF-1α. Bei niedrigem Sauerstoffgehalt steigt jedoch die Menge von HIF-1α, so dass sie das EPO-Gen sowie andere Gene mit HIF-bindenden DNA-Segmenten binden und damit regulieren kann (Abbildung 1). Mehrere Arbeitsgruppen zeigten, dass HIF-1α, das normalerweise schnell abgebaut wird, in Hypoxie vor dem Abbau geschützt ist. Bei normalem Sauerstoffgehalt baut eine zelluläre Maschine namens Proteasom, die 2004 mit dem Nobelpreis für Chemie für Aaron Ciechanover, Avram Hershko und Irwin Rose ausgezeichnet wurde, HIF-1α ab. Unter solchen Bedingungen wird dem HIF-1α Protein ein kleines Peptid, Ubiquitin, zugesetzt. Ubiquitin fungiert als Markierung für Proteine, die für den Abbau im Proteasom bestimmt sind. Wie Ubiquitin sauerstoffabhängig an HIF-1α bindet, blieb eine zentrale Frage.
Die Antwort kam aus einer unerwarteten Richtung. Etwa zur gleichen Zeit, als Semenza und Ratcliffe die Regulation des EPO-Gens untersuchten, forschte der Krebsforscher William Kaelin, Jr. an einem erblichen Syndrom, der von-Hippel-Lindau-Krankheit (VHL-Krankheit). Diese genetische Erkrankung führt zu einem dramatisch erhöhten Risiko für bestimmte Krebsarten in Familien mit vererbten VHL-Mutationen. Kaelin zeigte, dass das VHL-Gen für ein Protein kodiert, das den Beginn von Krebs verhindert. Kaelin zeigte auch, dass Krebszellen, denen ein funktionelles VHL-Gen fehlt, ungewöhnlich hohe Werte an hypoxiegeregulierten Genen exprimieren; aber dass, wenn das VHL-Gen wieder in Krebszellen eingeführt wurde, das normale Niveau wiederhergestellt wurde. Dies war ein wichtiger Hinweis darauf, dass VHL irgendwie an der Kontrolle der Reaktionen auf Hypoxie beteiligt war. Weitere Hinweise kamen aus mehreren Forschungsgruppen, die zeigten, dass VHL Teil eines Komplexes ist, der Proteine mit Ubiquitin markiert und sie für den Abbau im Proteasom markiert. Ratcliffe und seine Forschungsgruppe machten dann eine wichtige Entdeckung: Sie zeigten, dass VHL physikalisch mit HIF-1α interagieren kann und für seinen Abbau bei normalen Sauerstoffwerten erforderlich ist. Damit war VHL eindeutig mit HIF-1α verbunden.
Sauerstoff verschiebt die Balance
Viele Teile waren bereits vorhanden, aber was noch fehlte, war ein Verständnis dafür, wie O2-Werte die Interaktion zwischen VHL und HIF-1α regeln. Die Suche konzentrierte sich auf einen bestimmten Teil des HIF-1α-Proteins, von dem bekannt ist, dass es für den VHL-abhängigen Abbau wichtig ist, und sowohl Kaelin als auch Ratcliffe vermuteten, dass der Schlüssel zum O2-Sensor irgendwo in dieser Proteindomäne lag. Im Jahr 2001 zeigten sie in zwei gleichzeitig veröffentlichten Artikeln, dass unter normalen Sauerstoffwerten Hydroxylgruppen an zwei spezifischen Positionen in HIF-1α hinzugefügt werden (Abbildung 1). Diese Proteinmodifikation, die als Prolyl-Hydroxilierung bezeichnet wird, ermöglicht es VHL, HIF-1α zu erkennen und zu binden und so zu erklären, wie normale Sauerstoffwerte den schnellen HIF-1α-Abbau mit Hilfe von sauerstoffempfindlichen Enzymen (sogenannten Prolyl-Hydroxylasen) steuern. Weitere Forschungen von Ratcliffe und anderen identifizierten die verantwortlichen Prolylhydroxylasen. Es wurde auch gezeigt, dass die genaktivierende Funktion von HIF-1α durch sauerstoffabhängige Hydroxylierung reguliert wurde. Die Nobelpreisträger hatten nun den Sauerstoffsensor aufgeklärt und gezeigt, wie er funktioniert.
Sauerstoff prägt Physiologie und Pathologie
Dank der bahnbrechenden Arbeit dieser Nobelpreisträger wissen wir viel mehr darüber, wie unterschiedliche Sauerstoffwerte grundlegende physiologische Prozesse regulieren. Die Sauerstoffsensorik ermöglicht es den Zellen, ihren Stoffwechsel an einen niedrigen Sauerstoffgehalt anzupassen: zum Beispiel in unseren Muskeln bei intensivem Training. Weitere Beispiele für adaptive Prozesse, die durch Sauerstoffmessung gesteuert werden, sind die Erzeugung neuer Blutgefäße und die Produktion roter Blutkörperchen. Unser Immunsystem und viele andere physiologische Funktionen werden ebenfalls durch die O2-Sensorik verfeinert. Die Sauerstoffsensorik hat sich sogar während der fetalen Entwicklung als unerlässlich erwiesen, um die normale Blutgefäßbildung und Plazentaentwicklung zu kontrollieren.
Die Sauerstoffsensorik ist für eine große Anzahl von Krankheiten von zentraler Bedeutung (Abbildung 2). So leiden beispielsweise Patienten mit chronischem Nierenversagen aufgrund einer verminderten EPO-Expression oft unter schwerer Anämie. EPO wird von Zellen in der Niere produziert und ist, wie vorstehend erläutert, unerlässlich für die Kontrolle der Bildung von roten Blutkörperchen. Darüber hinaus spielt die sauerstoffregulierte Maschine eine wichtige Rolle bei Krebserkrankungen. In Tumoren wird die sauerstoffregulierte Maschine genutzt, um die Bildung von Blutgefäßen zu stimulieren und den Stoffwechsel für eine effektive Proliferation von Krebszellen umzugestalten. Die intensiven Bemühungen in akademischen Labors und Pharmaunternehmen konzentrieren sich nun auf die Entwicklung von Medikamenten, die verschiedene Krankheitszustände stören können, indem sie entweder die Sauerstoffsensorik aktivieren oder blockieren.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.
Originalveröffentlichung
Semenza, G.L, Nejfelt, M.K., Chi, S.M. & Antonarakis, S.E. (1991). Hypoxia-inducible nuclear factors bind to an enhancer element located 3’ to the human erythropoietin gene. Proc Natl Acad Sci USA, 88, 5680-5684
Wang, G.L., Jiang, B.-H., Rue, E.A. & Semenza, G.L. (1995). Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proc Natl Acad Sci USA, 92, 5510-5514
Maxwell, P.H., Wiesener, M.S., Chang, G.-W., Clifford, S.C., Vaux, E.C., Cockman, M.E., Wykoff, C.C., Pugh, C.W., Maher, E.R. & Ratcliffe, P.J. (1999). The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature, 399, 271-275
Mircea, I., Kondo, K., Yang, H., Kim, W., Valiando, J., Ohh, M., Salic, A., Asara, J.M., Lane, W.S. & Kaelin Jr., W.G. (2001) HIFa targeted for VHL-mediated destruction by proline hydroxylation: Implications for O2 sensing. Science, 292, 464-468
Jakkola, P., Mole, D.R., Tian, Y.-M., Wilson, M.I., Gielbert, J., Gaskell, S.J., von Kriegsheim, A., Heberstreit, H.F., Mukherji, M., Schofield, C.J., Maxwell, P.H., Pugh, C.W. & Ratcliffe, P.J. (2001). Targeting of HIF-α to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science, 292, 468-472