Wie ein körpereigenes Antibiotikum mit entzündungshemmender Wirkung hergestellt wird
Forscher geben Einblicke in die Itaconsäure-Synthese
Itaconsäure war lange Zeit nur als Stoffwechselprodukt von Pilzen bekannt. Seine Funktion war unbekannt, aber es wird seit Jahrzehnten weltweit industriell für die Kunststoffproduktion benutzt. Im Jahre 2013 wurde es überraschenderweise als wichtiges Stoffwechselprodukt im Immunsystem entdeckt. Diese neu beschriebene Rolle hat eine Suche nach klinischen Einsatzmöglichkeiten ausgelöst. Forscher des Helmholtz-Zentrums für Infektionsforschung (HZI) und des TWINCORE-Zentrums für Experimentelle und Klinische Infektionsforschung, einer gemeinsamen Einrichtung des HZI und der Medizinischen Hochschule Hannover, haben nun die Kristallstruktur des Itaconsäure-synthetisierenden Enzyms cis-Aconitat-Decarboxylase (CAD) gelöst. Ihre Ergebnisse liefern die Grundlage für ein besseres Verständnis der Itaconsäuresynthese, des Ursprungs dieses wichtigen Stoffwechselschrittes in der Evolution, und die Rolle der Itaconsäure im Immunsystem. Insbesondere identifizierten die Forscher natürlich vorkommende und möglicherweise klinisch wichtige Variationen im menschlichen CAD Enzym.
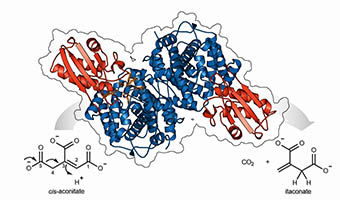
Kristallstruktur des Enzyms cis-Aconitate-Decarboxylase, das Itaconsäure synthetisiert.
©HZI/Peer Lukat
Die von aktivierten Immunzellen produzierte Itaconsäure nutzt zwei verschiedene Mechanismen, um das Immunsystem bei der Bekämpfung von Erregern zu unterstützen. Itaconsäure ist ein körpereigenes Antibiotikum, das von bestimmten Immunzellen aufgenommene Bakterien abtötet. Gleichzeitig wirkt sie als Signalmolekül, das den Zellstoffwechsel an die Immunaktivierung anpasst, indem sie versucht, überschießende Entzündungsreaktionen zu dämpfen. „Die Kristallstruktur des Enzyms CAD, das Itaconsäure herstellt, war bisher unbekannt. Dabei würde sie uns helfen zu verstehen, warum das Enzym in verschiedenen Organismen sehr unterschiedlich aktiv ist“, sagt Dr. Konrad Büssow, Wissenschaftler in der Abteilung „Struktur und Funktion der Proteine“ am HZI. Diese Wissenslücke haben die Forscher nun geschlossen und die CAD-Kristallstruktur von Mäusen und Menschen gelöst. „Obwohl das Enzym eine Decarboxylase ist, unterscheidet sich die Struktur unerwarteterweise sehr stark von anderen Decarboxylasen“, sagt Prof. Wulf Blankenfeldt, in dessen Abteilung die strukturbiologischen Analysen durchgeführt wurden. „Die einzigen verwandten Strukturen haben wir in Bakterien gefunden, die allerdings kein CAD besitzen. Wahrscheinlich haben sich alle diese Enzyme aus einem frühen gemeinsamen Vorläufer entwickelt.“
Um mehr über die Rolle der Itaconsäure bei Infektionen und Entzündungsprozessen zu erfahren, untersuchten die Forscher auch das Auftreten von CAD-Varianten in der Bevölkerung. „Wir haben die Hypothese, dass Mutationen, die die Aktivität des Enzyms erhöhen, einen besseren Infektionsschutz gegen bestimmte Bakterien bieten und das Risiko für chronische Entzündungen wie etwa rheumatoide Arthritis oder chronisch entzündliche Darmerkrankungen reduzieren“, sagt PD Frank Pessler, Leiter der Arbeitsgruppe „Biomarker für Infektionskrankheiten“ am TWINCORE. „Interessanterweise tritt in Populationen afrikanischer Abstammung eine bestimmte CAD-Mutation relativ häufig auf. Diese Mutation erhöht die Enzymaktivität. Der Grund dafür könnte die gemeinsame Evolution von Mykobakterien – zu denen die Tuberkuloseerreger gehören – mit den frühen Menschen in Afrika sein. So hätte die Mutation einen selektiven Vorteil für diese Menschen dargestellt.“ Die Forscher fanden, dass Mutationen, die zu einem Verlust der Itaconsäuresynthese führen, extrem selten sind. Auch dies deute darauf hin, dass die Itaconsäure in der menschlichen Evolution sehr wichtig gewesen sei; wahrscheinlich eben als Schutz vor bestimmten Infektionen und Entzündungsprozessen, sagt Pessler. Für die HZI-Forscher ist die Aufklärung der CAD-Kristallstruktur von daher auch ein wichtiger Schritt um untersuchen zu können, ob die unterschiedlichen Enzymaktivitäten ein Ziel für zukünftige Therapien darstellen können. „Außerdem“, sagt Büssow, „kann mit diesen Erkenntnissen das Enzym für technische Anwendungen optimiert und die Kunststoffherstellung so noch effizienter gemacht werden.“
Originalveröffentlichung
Fangfang Chen, Peer Lukat, Azeem Ahmed Iqbal, Kyrill Saile, Volkhard Kaever, Joop van den Heuvel, Wulf Blankenfeldt, Konrad Büssow, Frank Pessler; "Crystal structure of cis-aconitate decarboxylase reveals the impact of naturally occurring human mutations on itaconitate synthesis"; Proceedings of the National Academy of Sciences, 2019.