Schlüsselenzym in Pflanzen könnte die Entwicklung von Medikamenten und anderen Produkten steuern
Pflanzen können viele erstaunliche Dinge tun. Zu ihren Fähigkeiten gehört es, Verbindungen herzustellen, die ihnen helfen, Schädlinge abzuwehren, Bestäuber anzuziehen, Infektionen zu heilen und sich vor Übertemperaturen, Dürren und anderen Gefahren in der Umwelt zu schützen.
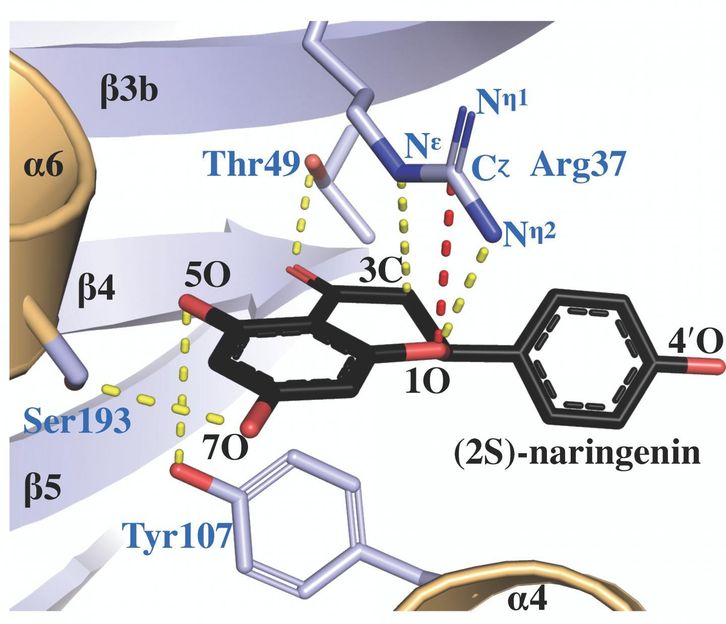
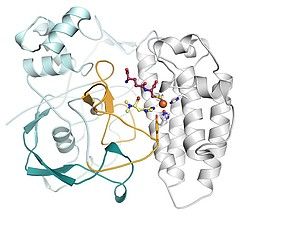
Die Protein-Röntgenkristallstruktur der Chalconisomerase, komplexiert mit einem Produktmolekül namens (2S)-Naringenin, zeigt, wie die aktive Stelle Arginin (markiert als Arg 37) die Katalyse des richtigen Isomers erleichtert.
Salk Institute/ACS Catalysis
Forscher des Salk Institute, die untersuchen, wie Pflanzen die Fähigkeiten entwickelt haben, diese natürlichen Chemikalien herzustellen, haben herausgefunden, wie sich ein Enzym namens Chalconisomerase entwickelt hat, damit Pflanzen Produkte herstellen können, die für ihr eigenes Überleben lebenswichtig sind. Die Forscher hoffen, dass dieses Wissen die Herstellung von Produkten, die für den Menschen von Nutzen sind, einschließlich Medikamenten und verbesserten Pflanzen, beeinflussen wird.
"Seitdem Landpflanzen vor etwa 450 Millionen Jahren zum ersten Mal auf der Erde erschienen sind, haben sie ein ausgeklügeltes Stoffwechselsystem entwickelt, um Kohlendioxid aus der Atmosphäre in eine Vielzahl von natürlichen Chemikalien in Wurzeln, Triebe und Samen umzuwandeln", sagt Salk Professor Joseph Noel. "Dies ist der Höhepunkt der Arbeit, die wir in den letzten 20 Jahren in meinem Labor geleistet haben, um die chemische Evolution der Pflanzen zu verstehen. Es gibt uns detailliertes Wissen darüber, wie Pflanzen diese einzigartige Fähigkeit entwickelt haben, einige sehr ungewöhnliche, aber wichtige Moleküle herzustellen."
Frühere Forschungen im Noel-Labor untersuchten, wie sich diese Enzyme aus Nicht-Enzymproteinen entwickelten, einschließlich der Untersuchung primitiverer Versionen von ihnen, die in Organismen wie Bakterien und Pilzen vorkommen.
Als Enzym wirkt die Chalconisomerase als Katalysator, um chemische Reaktionen in Pflanzen zu beschleunigen. Es hilft auch, sicherzustellen, dass die in der Pflanze hergestellten Chemikalien die richtige Form sind, da Moleküle mit der gleichen chemischen Formel zwei verschiedene Variationen annehmen können, die Spiegelbilder voneinander sind (Isomere genannt).
"In der pharmazeutischen Industrie ist es wichtig, dass die hergestellten Medikamente die richtige Version oder das Isomer sind, denn die Verwendung der falschen Version kann zu unbeabsichtigten Nebenwirkungen führen", sagt Noel, der Direktor des Jack H. Skirball Center for Chemical Biology and Proteomics von Salk ist. "Indem wir untersuchen, wie Chalconisomerase funktioniert, können wir mehr darüber erfahren, wie wir die Herstellung der richtigen Isomere von Arzneimitteln und anderen Produkten, die für die menschliche Gesundheit wichtig sein können, beschleunigen können."
In der aktuellen Studie untersuchten die Forscher mit verschiedenen strukturbiologischen Techniken die einzigartige Form des Enzyms und wie sich seine Form ändert, wenn es mit anderen Molekülen interagiert. Sie identifizierten den Teil der Struktur der Chalconisomerase, der es ihr ermöglichte, Reaktionen unglaublich schnell zu katalysieren und gleichzeitig sicherzustellen, dass sie das richtige, biologisch aktive Isomer bildet. Diese Reaktionen führen zu einer Vielzahl von Aktivitäten in Pflanzen, darunter die Umwandlung von Primärmetaboliten wie Phenylalanin und Tyrosin in lebenswichtige Spezialmoleküle, die Flavonoide genannt werden.
Es stellte sich heraus, dass eine bestimmte Aminosäure, Arginin, die eine von vielen Aminosäuren war, die in der Chalconisomerase miteinander verbunden waren, an einem Ort saß, der durch die Evolution geformt war, so dass sie die Schlüsselrolle bei der Katalyse von Chalconisomerase-Reaktionen spielen konnte.
"Durch Strukturstudien und Computermodellierung konnten wir die sehr genauen Positionen von Arginin innerhalb der aktiven Stelle des Enzyms im Laufe der Reaktion sehen", sagt Erstautor Jason Burke, ein ehemaliger Postdoc im Labor von Noel, der heute Assistenzprofessor an der California State University San Bernardino ist. "Ohne dieses Arginin funktioniert es nicht genauso."
Burke fügt hinzu, dass diese Art von Katalysator seit langem von organischen Chemikern gesucht wird. "Dies ist ein Beispiel dafür, dass die Natur bereits ein Problem löst, mit dem sich Chemiker schon seit langem beschäftigen", fügt er hinzu.
"Durch das Verständnis der Chalconisomerase können wir ein neues Instrumentarium schaffen, das Chemiker für die Reaktionen, die sie untersuchen, nutzen können", sagt Noel. "Es ist absolut notwendig, über dieses grundlegende Wissen zu verfügen, um molekulare Systeme zu entwerfen, die eine bestimmte Aufgabe auch in der nächsten Generation ernährungsphysiologisch dichter Pflanzen erfüllen können, die das Treibhausgas Kohlendioxid in lebenswichtige Moleküle umwandeln können."
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.