DNA-Reparatur: Erstmals vollständige Architektur eines Schlüsselenzyms aufgeklärt
LMU-Wissenschaftler haben erstmals die vollständige Architektur eines Schlüsselenzyms der DNA-Reparatur aufgeklärt und zeigen, dass Strukturänderungen für seine Funktion eine wichtige Rolle spielen.
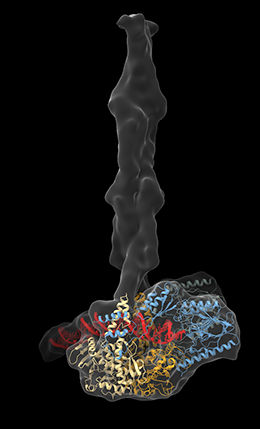
MR-Komplex.
L. Käshammer
DNA-Schäden können schwere Folgen für die Zelle und den ganzen Organismus nach sich ziehen. Besonders gefährlich ist es, wenn beide Stränge der DNA-Doppelhelix reißen. Solche Doppelstrangbrüche, die etwa durch Strahlung oder Umweltgifte entstehen, können die Zelle zum Absterben bringen. Deshalb besitzt die Zelle effiziente Reparaturmechanismen für Doppelstrangbrüche. Eine zentrale Rolle spielt dabei der sogenannte MR-Komplex, der Bruchstellen erkennt und deren Reparatur einleitet. Einem Team um Professor Karl-Peter Hopfner, Inhaber des Lehrstuhls für Structural Molecular Biology am Genzentrum der LMU, ist es nun erstmals gelungen, die Architektur dieses komplizierten Komplexes vollständig darzustellen und seine strukturellen Mechanismen aufzuklären.
Frühere Untersuchungen der Wissenschaftler zeigten bereits, dass der MR-Komplex aus insgesamt vier Enzymen besteht: Zwei Nukleasen, die DNA spalten, und zwei ATPasen, die das Molekül ATP spalten und auf diese Weise Energie gewinnen. Der Komplex hat zunächst eine offene Struktur. Erkennt er einen Doppelstrangbruch, bindet er an die DNA und wirkt als eine Art molekularer Klettverschluss, der die Bruchstelle umschließt und deren Reparatur einleitet, indem er DNA-Bauteile abspaltet und so die Bruchstelle für weitere Reparaturenzyme „säubert“. „Welche strukturellen Mechanismen dabei ablaufen, war bisher unklar, denn der Komplex hat eine komplizierte Architektur“, sagt Lisa Käshammer, die Erstautorin des Papers: An den ATPasen hängen sogenannte Coiled-Coils, das sind Proteinstrukturen, bei denen mehrere schraubenförmig gedrehte Aminosäureketten umeinander gewunden sind. Diese Coiled-Coils sind sehr lang und flexibel, deshalb lassen sie sich mit den bisher verwendeten kristallographischen Methoden nicht darstellen.
Mithilfe der Kryo-Elektronenmikroskopie gelang es den Wissenschaftlern nun, den MR-Komplex des Bakteriums E. coli erstmals vollständig strukturell zu untersuchen. In Bakterien ist der MR-Komplex etwas weniger komplex als in Eukaryonten, seine Struktur ist aber weitgehend konserviert, d.h. sie stimmt in Bakterien und Eukaryonten überein. Mit ihren Ergebnissen haben die Wissenschaftler die bisher offene Frage geklärt, wie die Nukleasen überhaupt an die DNA binden können: „In den bisher bekannten Strukturen war die DNA immer relativ weit vom aktiven Zentrum der Nuklease weg oder so gebunden, dass das aktive Zentrum blockiert war“, sagt Käshammer. Nun zeigte sich, dass eine elegante Drehung das Problem löst: Wenn DNA gebunden wird, schwenkt die Nuklease um etwa 120 Grad auf die Seite. Dadurch bildet sich ein Kanal, in dem die DNA ins aktive Zentrum der Nuklease binden kann.
Ein weiteres zentrales Ergebnis der neuen Studie ist die Funktion der Coiled-Coils: Wie die Wissenschaftler zeigen, legen sich diese Strukturen wie eine schmale Klammer um die DNA und sind aktiv an deren Bindung und Verarbeitung beteiligt. „Unsere Erkenntnisse sind ein wichtiger Schritt, um die komplexen Mechanismen der Reparatur von DNA-Doppelstrangbrüchen besser zu verstehen“, sagt Hopfner. Ein besseres Verständnis der Funktionsweise des Komplexes könnte auch medizinisch interessant sein, da Doppelstrangbrüche auch bei der Entstehung von Krebs eine wichtige Rolle spielen.