Struktur der Protein-Nanoturbine entschlüsselt
Erste Kryo-EM-Struktur des Drehmotors der Zelle bestimmt
Zellen erzeugen mit Hilfe der ATP-Synthese Energie - Adenosintriphosphat-(ATP)-Moleküle sind die Energielieferanten der meisten biologischen Prozesse in Lebewesen. Der Strukturbiologe Professor Leonid Sazanov und seine Forschungsgruppe vom Institute of Science and Technology Austria (IST Austria) in Klosterneuburg, Österreich, haben nun die erste atomare Struktur eines Enzyms aus der V/A-ATPase-Familie mit Hilfe der Kryo-Elektronenmikroskopie bestimmt und somit einen Beitrag geleistet, alle Evolutionsschritte dieser essentiellen molekularen Maschinen zu entschlüsseln. Die Kryo-EM-Bilder zeigen eine Struktur des Enzyms ähnlich einer Turbine oder Wassermühle.
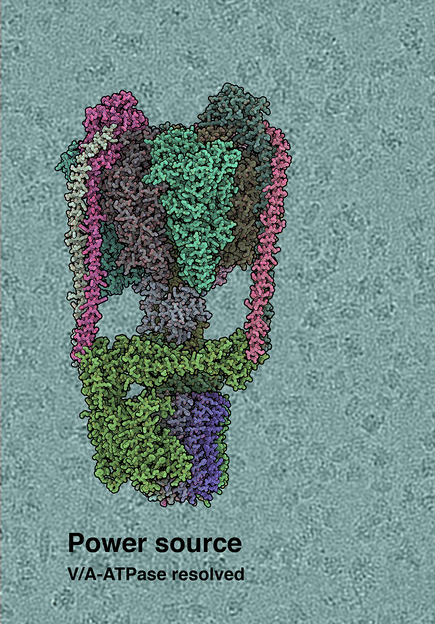
Kryo-EM Struktur der T. thermophilus V/A-type ATP Synthase. Der Hintergrund zeigt eine Rohversion des Kryo-EM Mikrobildes – einzelne ATPase Moleküle sind sichtbar.
(c) by IST Austria, 2019
Rotationskraft der Enzyme
ATP-Synthasen/ATPasen sind große Membranproteinkomplexe, die sich die gesamten-Baupläne teilen. Die Familie der ATP-Synthase/ATPase-Proteine umfasst den F-Typ des Enzyms, der in den Mitochondrien (Kraftwerken der Zelle), Chloroplasten (Organellen, die die Photosynthese in Pflanzen durchführen) und Bakterien vorkommt. Die Proteine bestehen aus einer kugelförmigen F1/V1/A1-Domäne, die ATP synthetisiert und einer Fo/Vo/Ao-Domäne, die in die Membran eingebettet ist und Protonen disloziert. F-Typ-Enzyme wurden bereits gut erforscht und ihre atomaren Strukturen sind bekannt. F1- und Fo-Domänen sind durch einen zentralen „Stiel“ oder so etwas wie einer Welle, einem Rotor miteinander verbunden, der sich innerhalb des F1 Bereiches dreht und so die ATP-Synthese antreibt. Der Rotor ist am sogenannten C-Ring befestigt, der durch die Protonenströmung zwischen dem Ring und dem in die Membran eingebetteten Stator angetrieben wird. Ein weiterer Stiel verhindert, dass sich dabei F1 selbst mitdreht – die F1 Domäne bleibt am Stator verankert. Die Gesamtarchitektur dieser einzigartigen molekularen Maschine ähnelt somit der einer Turbine oder einer Wassermühle, die in diesem Fall aber nicht von Wasser, sondern von einem Strom an Protonen angetrieben wird.
Die verschiedenen Arten von ATPasen
Enzyme vom F- und A-Typ werden normalerweise durch den Protonenfluss durch die Membran angetrieben und erzeugen so ATP. Die V-Enzyme arbeiten normalerweise entgegengesetzt und verbrauchen ATP, um Protonen zu pumpen. V- und A-ATPasen sind strukturell ähnlich, unterscheiden sich aber vom F-Typ durch zwei oder drei periphere Stiele und zusätzliche Verbindungsuntereinheiten zwischen den Einheiten V1 und Vo. V-Typ-Enzyme haben sich wahrscheinlich aus dem A-Typ entwickelt und werden aufgrund der Gemeinsamkeiten auch als V/A-ATPase bezeichnet. Einige Bakterien, darunter Thermus thermophilus, verwenden ein Enzym vom Typ A für ihre Energiegewinnung. Long Zhou, Postdoc in der Gruppe des IST Austria Professor Leonid Sazanov, hat nun das A-Typ Enzym ThV1Vo mittels Kryo-EM untersucht. Im Gegensatz zum F-Typ konnten bei V-Typ-ATPasen die Strukturen V1- und Vo-Domänen bisher nur getrennt voneinander bestimmt werden, nicht aber das gesamte Enzym. Daher war bisher unbekannt, wie V1 an Vo eigentlich aneinander gekoppelt ist und das Wissen über den vollständigen katalytischen Zyklus fehlte.
Plastizität und Wettbewerb
Die Wissenschaftler bestimmten nicht nur eine, sondern insgesamt fünf Strukturen des gesamten ThV1Vo-Enzyms mit Hilfe der Kryo-Elektronenmikroskopie. Sie stellten mehrere Konformationen des Proteins dar, die sich durch die Position des Rotors im Inneren des Stators unterscheiden. Es zeigte sich, dass die generelle Plastizität der verschiedenen Proteinkonformationen von ThV1Vo durch ein „Wackeln“ der Untereinheit V1 und so von einem Zustand in den anderen übergeht. Die Plastizität entsteht durch den Wettbewerb mechanischer Eigenschaften zwischen dem gebogenen, zentralen Rotor gegen die Steifigkeit des Stators. Die V1-Vo-Kopplung erfolgt durch eine enge strukturelle und elektrostatische Übereinstimmung zwischen der „Welle“ und der V-spezifischen Untereinheit, die sie mit dem C-Ring des Moleküls verbindet. Die Visualisierung des Weges, den die Protonen in V-ATPasen durchwandern, zeigte schließlich signifikante Unterschiede in der Verteilung der geladenen Proteinreste zu F-ATPasen, denn hier verhindert ein strengerer „Checkpoint“ ein „Verrutschen“ des Enzyms.
Warum zusätzliche Komplexität?
Anstelle eines einzigen peripheren Stiels wie bei den F-Typ-Enzymen haben A-Typ Enzyme wie das am IST Austria untersuchte ThV1Vo zwei periphere Stiele, während eukaryotische V-Typen sogar drei davon haben. Aber was ist der Vorteil der zusätzlichen Komplexität in dem ohnehin schon sehr großen Proteinmolekül, in dem auch noch zusätzliche Untereinheiten die Bereiche V1 und Vo verbinden? Die F1/V1-Domäne weist eine dreifache Symmetrie auf, so dass mit jeder 120° Drehung des Stators innerhalb von F1/V1 ein ganzes ATP-Molekül erzeugt (oder verbraucht) wird. Professor Leonid Sazanov erklärt: „In V/A-ATPasen geschieht dies in einem einzelnen Schritt mittels einer Drehung um 120°. Im Gegensatz zur F-ATP-Synthase ist diese Drehung in mehrere Teilschritte unterteilt. Daher könnte in ThV1Vo eine höhere Plastizität erforderlich sein, um diese 120°-Drehungen in V1 durch kleinere Schritte pro c Untereinheit in der Einheit Vo mit dem c12-Ring zu verbinden. Diese zusätzliche Flexibilität kann bei V-Typen auch durch die zusätzlichen peripheren Stiele und Verbindungselemente erreicht werden. Durch die jetzige Entschlüsselung der Strukturen beginnen wir zu verstehen, wie dies tatsächlich erfolgt, und können daraus auch Schlüsse für die gesamte V-ATPase-Familie ziehen".
Originalveröffentlichung
Zhou, L. and Sazanov, L.A.; "Structure and Conformational Plasticity of the Intact Thermus thermophilus V/A-type ATPase"; Science; 2019, in press.