Plan B beim Cholesterintransport
Forschungsteam weist bislang unbekannten, alternativen Cholesterin-Transportweg im Zellinneren nach
Cholesterin ist ein lebenswichtiger Zellbaustein bei Mensch und Tier und elementarer Bestandteil der sogenannten Zellmembran. Diese Grenzschicht trennt das Zellinnere von den Nachbarzellen und dem Umgebungsmilieu ab. Sie sorgt mittels bestimmter Proteine dafür, dass diverse Botenstoffe in die Zelle hinein- oder hinausgelangen. Zudem ist Cholesterin die Vorstufe verschiedener Hormone und Gallensäuren. Der Cholesterinspiegel im Blut steht außerdem im Zusammenhang mit zahlreichen Erkrankungen, insbesondere des Herz-Kreislauf-Systems, aber auch mit den zwar sehr seltenen, aber besonders gravierend verlaufenden sogenannten lysosomalen Speicherkrankheiten. Forscher am Biochemischen Institut der Christian-Albrechts-Universität zu Kiel (CAU) untersuchen bereits seit Jahren unter anderem, wie Cholesterin im Zellinnern transportiert wird und welche Prozesse und Proteine daran beteiligt sind. So gelang es ihnen 2013, ein zentral an diesen Prozessen beteiligtes Protein, das sogenannte LIMP2, zu charakterisieren und seinen molekularen Bauplan zu beschreiben. Das dabei entstandene räumliche Modell des Proteins offenbarte überraschenderweise eine Tunnelstruktur, die ähnlich wie bei anderen Proteinen auf eine mögliche Transportfunktion des LIMP2 hindeutete. In einer gemeinsam mit internationalen Kollegen unter anderem von der Zhejiang-Universität und der Universität Helsinki vorgelegten Forschungsarbeit konnte das Kieler Forschungsteam nun die Beteiligung des LIMP2-Proteins am Cholesterin-Export aus Lysosomen, den abbauenden Zellorganellen, nachweisen. Damit beschrieben die Forscher einen bislang unbekannten Weg des Cholesterinabbaus im Zellinnern.
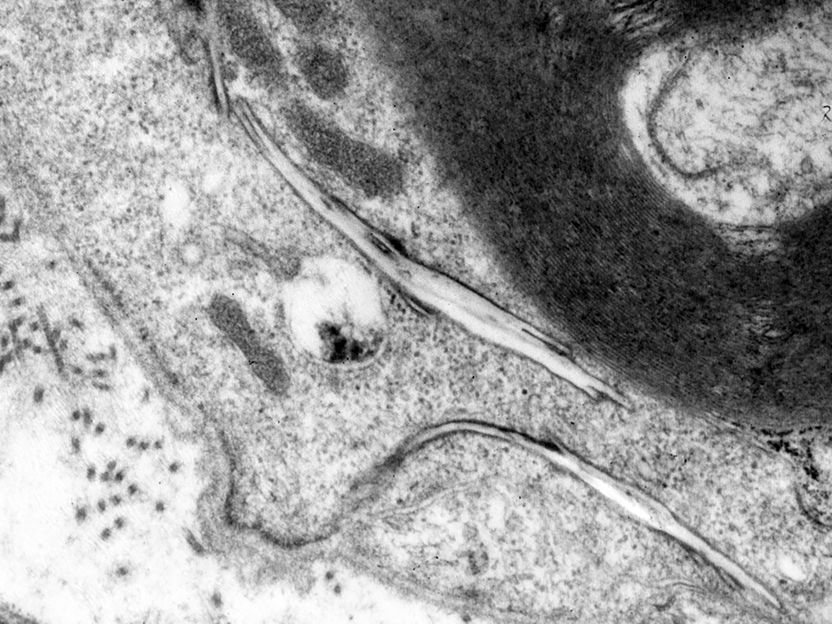
Unter dem Elektronenmikroskop zeigt sich, wie sich Cholesterin bei einer Störung des Abbaumechanismus in länglichen, kristallartigen Strukturen (Bildmitte) im Nervengewebe ansammelt.
© Prof. Renate Lüllmann-Rauch
Verteilerknoten der Zelle
Im Mittelpunkt des Interesses steht für das Kieler Biochemie-Forschungsteam um Professor Paul Saftig die Rolle der Lysosomen. Diese Zellorganellen sorgen in menschlichen und tierischen Zellen für die Verteilung sowie den Ab- und Umbau diverser Stoffe, unter anderem auch des Cholesterins. Bereits bekannt war, dass ein bestimmtes Protein für den Transport des Cholesterins aus den Lysosomen verantwortlich ist. „Die auffällige Tunnelstruktur unseres neu charakterisierten Proteins ließ uns hellhörig werden“, beschreibt Biochemiker Saftig den Ausgangspunkt der aktuellen Forschungen. „Durch unsere Experimente konnten wir nun bestätigen, dass LIMP2 tatsächlich für einen alternativen Transportweg des Cholesterins verantwortlich ist“, so Saftig weiter.
Warum es diesen parallelen Weg gibt, der zudem weniger effizient abläuft als der bereits bekannte Mechanismus, ist noch unklar. „Aktuell haben wir festgestellt, dass beide Pfade zum Teil die Aufgabe des anderen übernehmen können“, betont Saskia Heybrock, Doktorandin am Biochemischen Institut und eine der Erstautorinnen der Veröffentlichung. „Wenn wir den Mechanismus des LIMP2-Transports deaktivierten, häufte sich Cholesterin nicht deutlich an, da es weiterhin auf dem primären Weg abgebaut wird“, so Heybrock. Trotzdem vermuten die Forscher, dass die beiden Wege nicht vollständig redundant seien und der LIMP2-Tunnel insbesondere für bestimmte Zelltypen zuständig sein könnte.
Schädliche Cholesterin-Anhäufung
Nachweise für die Funktion des LIMP2-Proteintunnels erlangte das internationale Forschungsteam anhand verschiedener Methoden. In einer lichtmikroskopischen Analyse gelang es den Forschern, das Cholesterin gewissermaßen ‚auf frischer Tat zu ertappen‘: Dank einer Fluoreszenz-Markierung bildeten sie es in dem Moment ab, in dem es den Tunnel passiert hatte. Elektronenmikroskopische Aufnahmen zeigten darüber hinaus sogar, wie sich Cholesterin in bestimmten Nervengeweben ansammelt, sobald der LIMP2-Transportweg nicht zur Verfügung steht. Eine funktionale Genanalyse ergab zudem, dass die Deaktivierung der für das LIMP2-Protein verantwortlichen Erbinformationen zu einer Störung des zellulären Cholesterin-Gleichgewichts führt. Die Zellen aktivieren in diesem Fall vermehrt Signale, die einen Cholesterinmangel anzeigen, was zu einer problematischen und möglicherweise an der Krankheitsentstehung beteiligten Anhäufung von Cholesterin führt.
„Mit der neuen Arbeit konnten wir einen zusätzlichen Transportweg beschreiben, der an der Cholesterin-Regulierung beteiligt ist“, fasst Saftig die Bedeutung der neuen Veröffentlichung zusammen. „Das immer genauere Verständnis dieser zellulären Transport- und Verteilungsprozesse wird uns in Zukunft dabei helfen, Ansatzpunkte für neue Therapien zu finden“, so Saftig weiter. Die Wissenschaftler hoffen daher, perspektivisch insbesondere Wirkstoffe zur Bekämpfung der lysosomalen Speicherkrankheiten entwickeln zu können. In einem nächsten Schritt auf diesem Weg wollen die Kieler Forscher zunächst die unterschiedlichen Funktionen der scheinbar redundanten Wege des Cholsterintransports im Zellinnern aufklären.





















































