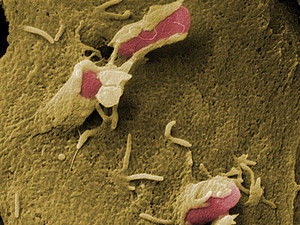
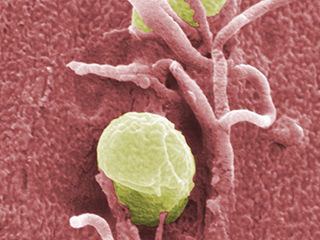
Wie Pesterreger das Immunsystem austricksen
Forscher zeigen, wie ein Enzym seine Gestalt verändert und dadurch die Infektion fördert
Yersinien verbreiteten vor allem in vergangenen Zeiten Angst und Schrecken, doch die Pesterreger sind auch heute noch nicht vollständig ausgerottet. Die Bakterien spritzen verschiedene Enzyme, darunter das Enzym YopO, in die Fresszellen des Immunsystems. Dort wird es aktiviert und hindert die Abwehrzellen daran, die Pestbakterien zu umschließen und zu verdauen. Mit neuesten Methoden haben Wissenschaftler des Instituts für Physikalische und Theoretische Chemie der Universität Bonn nun entschlüsselt, wie YopO seine Gestalt verändert und damit dazu beiträgt, das Immunsystem zu verwirren.

Bereiten im Labor eine Messung vor: Martin Peter (links) und Dr. Gregor Hagelüken (rechts) vom Institut für Physikalische und Theoretische Chemie der Universität Bonn.
© Foto: Hamed Alai
Zu den Yersinien gehört auch der Pesterreger, der bis zur Entdeckung der Antibiotika weltweit für Angst und Schrecken sorgte. Die großen Epidemien sind vorbei, doch die Weltgesundheitsorganisation (WHO) meldete zwischen 1978 und 1992 insgesamt 1451 Todesfälle in 21 Ländern. Pestbakterien kommen auch noch in wildlebenden Nagetieren vor. Die Übertragung erfolgt überwiegend über Flöhe, aber auch durch Tröpfcheninfektion. „Yersinien tricksen die Makrophagen des Immunsystems aus“, sagt Dr. Gregor Hagelüken vom Institut für Physikalische und Theoretische Chemie der Universität Bonn.
Der Strukturbiologe erforschte bereits als Doktorand am Helmholtz-Zentrum für Infektionsforschung in Braunschweig Yersinien. Die Besonderheit der Pesterreger ist eine Art Spritze, mit der sie das Enzym YopO und einige andere Enzyme in die Fresszellen (Makrophagen) des Immunsystems injizieren. YopO wird aber erst aktiv, wenn es an das Aktin der Fresszelle bindet. Normalerweise hilft das Strukturprotein Aktin dabei mit, dass die Fresszelle Ausstülpungen bilden kann, mit der sie die Erreger umfließt und dann zerkleinert. Bei dem Vorgang ruft die Fresszelle weitere Abwehrzellen um Hilfe.
YopO bringt die Kommunikation des Immunsystems durcheinander
„Sobald aber YopO an das Aktin gebunden hat, trägt es dazu bei, die Kommunikation innerhalb des Makrophagen zu stören - er kann nicht mehr angreifen“, berichtet Hagelüken. „Die Yersinien bleiben letztlich unbehelligt.“ Forscher fragen sich schon länger, wie YopO durch die Bindung an Aktin aktiviert und damit der Schalter für den dramatischen Verlauf umgelegt wird. „Wissenschaftler der Universität Oxford und der National University of Singapore haben bereits 2015 die Struktur des ans Aktin gebundenen YopO entschlüsselt“, berichtet Hagelükens Mitarbeiter und Erstautor Martin F. Peter. Allerdings handelte es sich bei den Strukturaufnahmen um eine Art „Standbild“: Es war nicht erkennbar, wie das YopO seine Gestalt verändert, wenn es ans Aktin bindet.
„Enzyme sind nicht steife Strukturen, sondern verfügen über etliche bewegliche `Scharniere´, mit der sie ihre Form verändern können“, erklärt Hagelüken. Die Forscher wollten zwei „Schnappschüsse“ aufnehmen: Einen von YopO alleine und in einem zweiten Durchgang einen von dem YopO/Aktin-Komplex. Auf diesen „Vorher-Nachher-Bildern“ sollte sich erkennen lassen, wie die beiden Partner durch die Komplexbildung ihre Gestalt verändern. „Diese Idee war eine Herausforderung, da die normale Methode der Kristallstrukturanalyse bei dem freien YopO nicht funktionierte. Wie sich herausstellt, ist es zu flexibel, um geordnete Kristalle zu bilden“, sagt Peter.
Neueste Werkzeuge der Strukturaufklärung
Die Wissenschaftler der Universität Bonn bedienten sich deshalb gleich mehrerer Instrumente aus dem Werkzeugkasten der Strukturaufklärung. Mit Dr. Dmitri Svergun vom European Molecular Biology Laboratory in Hamburg nutzten sie den Elektronenbeschleuniger PETRA III des Deutschen Elektronen-Synchrotrons DESY. „Mit den extrem intensiven und gebündelten Röntgenstrahlen kann man mithilfe der sogenannten Röntgenkleinwinkelstreuung die Gesamtstruktur und strukturelle Veränderungen von in Wasser gelösten Enzymen studieren“, sagt Svergun.
Zusätzlich brachten die Forscher an bestimmten Positionen des YopO und des Aktin Spin-Marker an. Sie funktionieren wie Vermessungspunkte in der Landschaft, an denen zum Beispiel die exakte Lage eines Grundstücks ermittelt werden kann. „Anhand der Spin-Marker können wir mit einem molekularen Linear – der PELDOR-Methode – die Nanometer Abstände zwischen diesen Positionen vermessen und dadurch bestimmen, wie YopO und Aktin ihre Form verändern“, berichtet Hagelüken. Bislang wurde vermutet, dass YopO wie eine Schere eine Klappbewegung ausführt, sobald es an Aktin bindet. „Unsere Ergebnisse deuten aber darauf hin, dass es sich nicht um eine größere Bewegung, sondern viele kleine handelt, mit der YopO in den aktiven Zustand übergeht“, sagt Peter.
Grundlagen für maßgeschneiderte Substanzen
Rechtzeitig erkannt, lässt sich die Pest gut mit Antibiotika heilen. „Allerdings können Bakterien bei häufiger Antibiotika-Anwendung resistent werden, wodurch die Medikamente nicht mehr richtig wirken“, sagt Hagelüken. Wenn die grundlegenden Prozesse von Erregern, mit der sie das Immunsystem überlisten, besser verstanden werden, könnten vielleicht auch gezielter maßgeschneiderte Substanzen zu deren Hemmung entwickelt werden.