Im aktiven Zentrum der Kohlendioxid-Fixierung
Forscher entschlüsseln, warum manche Enzyme Kohlendioxid effizienter umwandeln können
Um die Klimakrise zu bewältigen, muss der Mensch einerseits dringend Kohlendioxid-Emissionen reduzieren. Gleichzeitig müssen neue Wege gefunden werden, der Atmosphäre aktiv Kohlendioxid zu entziehen. Letzteres ist Ziel der Forscher um Tobias Erb vom Max-Planck-Institut für terrestrische Mikrobiologie in Marburg. Ihre Ansätze sollen langfristig nicht nur dem Klimaschutz, sondern auch der Nachhaltigkeit zugutekommen: Kohlendioxid raus aus der Luft, rein in den Wertstoffzyklus.
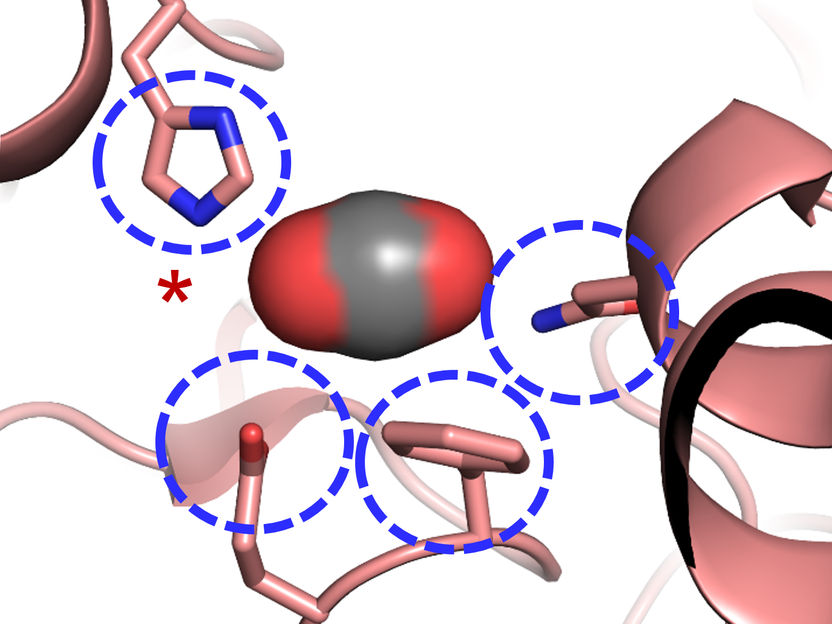
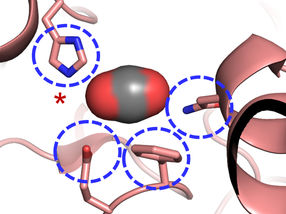
Das aktive Zentrum der Carboxylase: Vier Aminosäuren sind für die Effizienz der CO2-Fixierung verantwortlich.
© Max-Planck-Institute for Terrestrial Microbiology/Erb
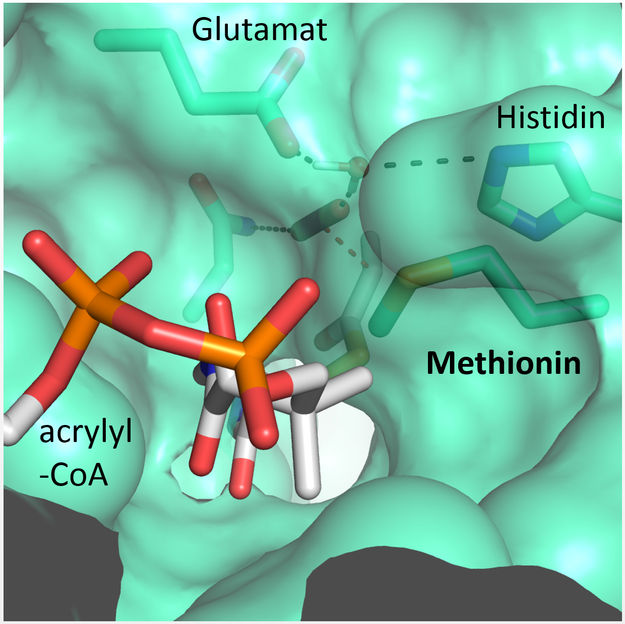
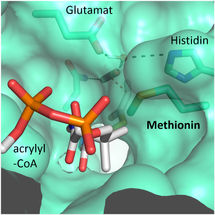
Ein Methioninrest schützt das aktive Zentrum vor den konkurrierenden Wassermolekülen.
© Max-Planck-Institute for Terrestrial Microbiology/Erb
Raus aus der Luft - die Natur kann das, denn sie wandelt Kohlendioxid seit jeher mittels Fotosynthese in Biomasse um. Anders als industrielle Anlagen, welche Kohlendioxid-Gas nur in hochkonzentrierter Form umsetzen können, was wiederum fossile Energie verbraucht, arbeitet die Fotosynthese direkt mit der Umgebungsluft, die das Kohlendioxid nur zu einem Anteil von 0,04 Prozent enthält.
Ihr Geheimnis steckt in den Enzymen. Diese Proteine steuern als Biokatalysatoren gezielte chemische Reaktionen, wie zum Beispiel das Enzym RubisCO, mit dem die Fixierung von Kohlendioxid in der Fotosynthese betrieben wird. Allerdings ist die Effizienz der natürlichen Fotosynthese nicht hoch: Der Sauerstoff in der Luft ist bei dieser Reaktion ein starker Konkurrent des Kohlendioxid. Bei der RubisCO kommt er in mehr als einem Viertel der Fälle zum Zuge, was die natürliche Fotosyntheseleistung einschränkt.
ECR-Enzyme: schneller und präziser als RubisCo
Die Forscher um Tobias Erb haben sich daher auf Alternativen zur RubisCO verlegt. Denn die gibt es durchaus: Enzyme aus der Klasse der Enoyl-CoA Carboxylasen/Reduktasen (ECR) arbeiten um mehrere Größenordnungen schneller als die RubisCO und machen keinen Fehler mit Sauerstoff. Um der Natur diese Fähigkeit abzuschauen, braucht es langen Atem und viel Akribie. Die Max-Planck-Forscher haben nun einen Prozess im Reagenzglas entwickelt, der Kohlendioxid besser umwandelt als die in der Natur vorkommenden Wege der Fotosynthese. Höchste Robustheit und Energieeffizienz sind dabei die Eigenschaften, die das Team seiner künstlichen Fotosynthese verleihen möchte. Die Natur selbst dient als molekularbiologischer Lehrmeister.
Doch woran liegt die hohe Effizienz der ECRs? Was sind die Schrauben, an denen man drehen muss, um einen Turbo-CO2-Fixierer zu entwickeln? Dieser Frage gingen die Max-Planck-Nachwuchsforscher Gabriele Stoffel und Iria Bernhardsgrütter gemeinsam mit Kollegen aus Chile und den USA nach. Sie analysierten die die ECR aus dem Bakterium Kitasatospora setae, die derzeit schnellste bekannte Carboxylase. In einem kombinierten Ansatz aus Strukturbiologie, Biochemie und Computersimulationen konnten sie zum ersten Mal verstehen, wie das Enzym Kohlendioxid bindet und umwandelt.
Teamwork im aktiven Zentrum
„Wir waren erstaunt zu sehen, dass vier Aminosäuren ausreichen, um dem Protein höchstmögliche Kontrolle über das Kohlendioxid-Molekül zu verleihen“ erklärt Gabriele Stoffel, Postdoktorand im Labor von Tobias Erb und Erstautor der Studie. „Drei Aminosäuren – Asparagin, Glutamat und Histidin – verankern gemeinsam das Kohlendioxid von zwei Seiten. Eine weitere Aminosäure, ein Phenylalanin, schirmt das gebundene Kohlendioxid wie ein Schutzschild gegen Wasser ab, das die Reaktion hemmen würde“, so Stoffel weiter.
Diese Erkenntnisse erschließen den Forschern neue Ufer. „Wir wollten die Fähigkeit auf andere Enzyme übertragen, Kohlendioxid zu binden. Damit hätten wir für die Optimierung der künstlichen Fotosynthese einen viel größeren Spielraum“, so Iria Bernhardsgrütter, Doktorandin der Arbeitsgruppe. Bernhardsgrütter konzentrierte sich in einer weiteren Studie gleich auf zwei Kandidaten für das Protein-Gerüst: Propionyl-CoA Synthase (PCS) und Archaeal Enoyl-CoA reductase (AER).
Erhöhung der CO2-Fixierungskapazität
Beide Enzyme konnten bereits etwas Kohlendioxid verwenden, allerdings nur mit einer Effizienz von unter fünf Prozent und mit angereichertem Kohlendioxid. Wie computerunterstützte Modellierungen zeigten, besaßen die Enzyme im aktiven Zentrum nur einige der vier erforderlichen Aminosäuren, die teilweise auch nicht richtig ausgerichtet waren.
Iria Bernhardsgrütter gelang es mit Aminosäure-Austauschen, die Fehlorientierung in der PCS zu korrigieren. Prompt stieg die Effizienz der Kohlendioxid-Umwandlung auf 20 Prozent. Es fehlte aber der zweite Aspekt, das Abschirmen des Kohlendioxid gegen Wasser. Auch das konnte die Forscherin lösen: Der Austausch einer weiteren Aminosäure versperrte dem Wasser den Zugang zur Bindungsstelle. Die Kombination beider Veränderungen führte unter optimalen Bedingungen zu einer Effizienz von fast 95 Prozent. Ähnliche Versuche in der AER steigerten die Kohlendioxid-Umwandlungseffizienz des Enzyms auf ebenfalls fast 90 Prozent.
Mit dem Wissen über die genauen Erfordernisse der Kohlendioxid-fixierenden Enzyme und der Möglichkeit, dieses erfolgreich anzuwenden, sind die Forscher ihren hohen Zielen einen entscheidenden Schritt nähergekommen: einerseits das Kohlendioxid effizient aus der Atmosphäre filtern zu können, andererseits diesen Zyklus in eine nachhaltige Nutzung von Kohlendioxid einzubinden – Wertstofferhalt nach dem Vorbild der Natur.
Originalveröffentlichung
Stoffel, G. M. M.; Saez, D. A.; DeMirci, H.; Vögeli, B.; Rao, Y.; Zarzycki, J.; Yoshikuni, Y.; Wakatsuki, S.; Vöhringer-Martinez, E.; Erb, T. J.; "Four amino acids define the CO2 binding pocket of enoyl-CoA carboxylases/reductases"; Proceedings of the National Academy of Sciences 201901471 (2019).
Bernhardsgrütter, I.; Schell, K.; Peter, D. M.; Borijan, F.; Saez, D. A.; Vöhringer-Martinez, E.; Erb, T.; "Awakening the Sleeping Carboxylase Function of Enzymes:Engineering the Natural CO2‑Binding Potential of Reductases"; Journal of the American Chemical Society 141, 9778 −9782 (2019).























































