Serienkiller im Dienst des Immunsystems
natürliche Killerzellen können uns vor Krebs schützen, indem sie Tumorzellen umbringen. Das gelingt ihnen über unterschiedliche Wege. Wann die Immunzellen welchen Mechanismus nutzen, ist bislang jedoch kaum untersucht. Forscher des Leibniz-Instituts für Arbeitsforschung konnten mit einem internationalen Team zeigen, dass eine Immunzelle nicht zufällig entscheidet, wie sie die Tumorzellen der Reihe nach tötet. Die Wahl des Angriffsweges ist zeitlich gesteuert, da die beiden Optionen unterschiedlich effektiv sind.
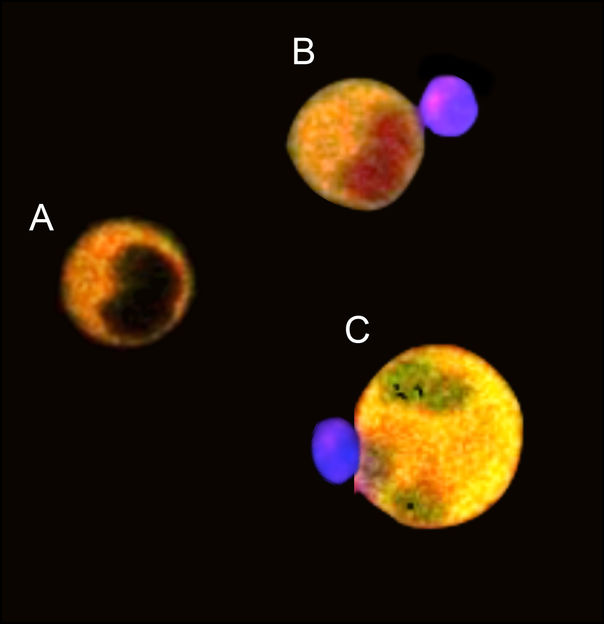
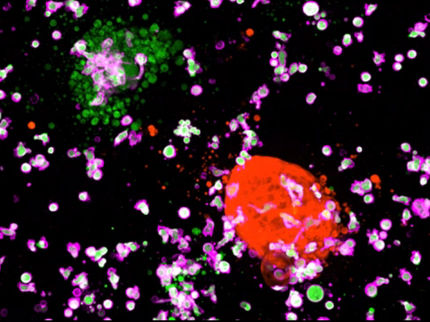
Tumorzellen mit Fluoreszenzmarker(gelb), Zellkern bei lebenden Zellen ungefärbt (A). Wenn NK-Zellen (lila) die Tumorzellen umbringen, färbt sich je nach Angriffsweg der Zellkern rot (B) oder grün (C)
IfADo
Die Natürlichen Killerzellen (NK-Zellen) bilden eine der ersten Verteidigungslinien im Körper im Kampf gegen Infektionen und Krebs. Sie können nicht nur einzelne Tumorzellen umbringen. Einige NK-Zellen werden auch als „Serienkiller“ aktiv: Sie greifen mehrere Zellen nacheinander an, um effektiv vor Krankheiten zu schützen. Es ist bekannt, dass die NK-Zellen dafür zwei Wege nutzen können.
Im ersten Fall docken die NK-Zellen an die Tumorzellen an und schleusen bestimmte Enzyme über Poren in die Zelle. Die Enzyme verbreiten sich, spalten Eiweiße und können den Zelltod einleiten. Neben diesem Mechanismus kann die NK-Zelle der Tumorzelle auch einen „Todeskuss“ geben: Sie bindet dafür spezifisch an die Oberfläche der Tumorzelle, an den sogenannten Todesrezeptor. Auf diese Weise wird in der Tumorzelle eine enzymatische Kettenreaktion ausgelöst, die den programmierten Zelltod auslöst.
Wie die NK-Zelle beim Töten der Zellen vorgeht, ob sie sich zufällig für einen der Wege entscheidet oder bestimmten Regeln folgt, ist kaum erforscht. In einer aktuellen Studie sind Immunologen am Leibniz-Institut für Arbeitsforschung an der TU Dortmund (IfADo) zusammen mit Forschenden aus Heidelberg und Stockholm dieser Frage nachgegangen.
Dazu haben sie im Labor NK-Zellen aus Proben von Blutspendern isoliert und mit Tumorzellen in Kontakt gebracht. Die Interaktionen der Zellen wurden bis zu 16 Stunden untersucht. Um zu analysieren, wann die Zellen welchen Todesmechanismus einleiten, hat das Team spezielle Fluoreszenzmarker entwickelt. Diese Moleküle reagieren spezifisch auf die für den jeweiligen Mechanismus verantwortlichen Enzyme: Der Zellkern färbte sich entweder rot oder grün, je nachdem, welches Enzym in der Tumorzelle präsent war.
Strategiewechsel mit der Zeit
„Auf diese Weise konnten wir unter dem Mikroskop zu schauen, wie die NK-Zellen arbeiten“, erklärt IfADo-Immunologe und Studienautor Prof. Dr. Carsten Watzl. Es zeigte sich, dass die Wahl des Mechanismus zeitlich gesteuert ist. „Beim Kontakt mit der ersten Tumorzelle nutzten fast alle NK-Zellen den Weg über die Ausschüttung von Enzymen. Diese Wahl erlaubt eine schnellere Beseitigung der Tumorzellen im Vergleich zum Mechanismus über den Todeskuss“, so Watzl. Für den weiteren Verlauf konnten die Forscher feststellen, dass die NK-Zellen ihre Strategie anpassen: Beim letzten Aufeinandertreffen von einer NK-Zelle mit einer Tumorzelle wählten fast alle Immunzellen in der Studie den Weg über den Todeskuss.
„Unsere Messungen zeigen, dass durch die wiederholten, schnellen Angriffe die Anzahl der Enzyme in den NK-Zellen sinkt, die den Tod in der Tumorzelle einleiten. Der Mechanismus über die Bindung an den Todesrezeptor stellt somit ein Back-up dar, damit die erschöpfte NK-Zelle weiter angreifen kann“, erklärt Watzl. Jedoch sind die beiden Angriffswege auch unterschiedlich effektiv. Über die Ausschüttung der Enzyme konnten die NK-Zellen als Serienkiller mehrere Tumorzellen hintereinander abtöten. Wenn die Forschenden aber diesen Angriffsweg blockierten, konnten die NK-Zellen nur jeweils eine einzige Tumorzelle über den Todeskuss umbringen. Warum der Weg über den Todeskuss kein Abtöten von mehreren Tumorzellen ermöglicht, ist noch nicht geklärt.
Folgestudien zur Erholung der NK-Zellen geplant
Grundsätzlich können die vorgestellten Erkenntnisse aus der Grundlagenforschung dabei helfen, die Erforschung von Immuntherapien gegen Krebs zu verbessern – der Medizin-Nobelpreis 2018 wurde für Forschungsarbeiten in diesem Kontext verliehen.
So soll in Folgestudien untersucht werden, wie die NK-Zellen gezielt dabei unterstützt werden können, sich von dem Verlust bestimmter Enzyme zu erholen und ob die Aktivitäten der T-Zellen, die ebenfalls kranke Zellen umbringen können, ähnlich zeitlich gesteuert sind. Weitere Forschung ist zudem nötig, um zu verstehen, wieso nur manche NK-Zellen als Serienkiller aktiv werden.