Auflösen von Proteinstau am Eingang von Mitochondrien
Freiburger Forscher entdecken einen molekularen Mechanismus, der den Proteinverkehr in die Kraftwerke der Zelle freihält
Die Arbeitsgruppe von Privatdozent Dr. Thomas Becker an der Universität Freiburg hat einen neuen molekularen Mechanismus entdeckt, über den Blockaden im Proteinverkehr in die Kraftwerke der Zelle beseitigt werden.
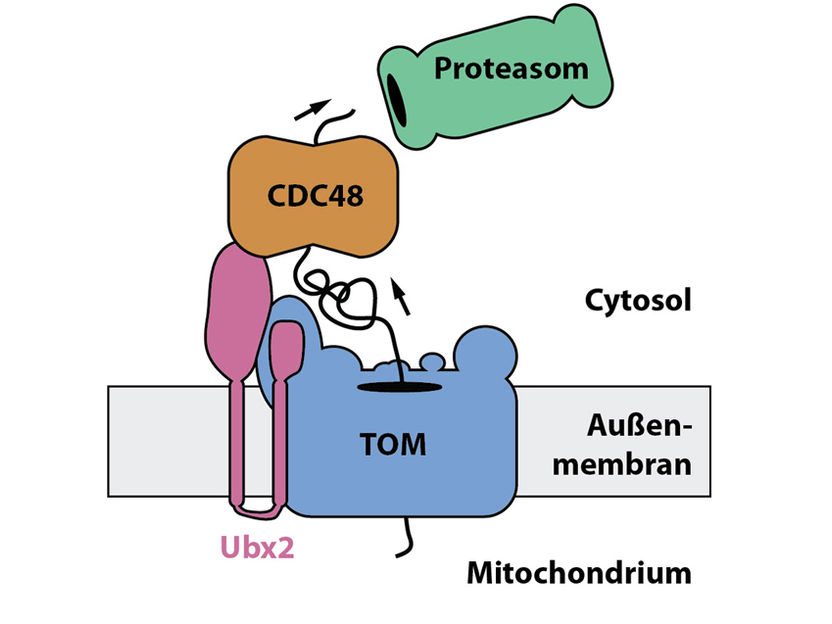
Im Zusammenspiel entfernen die Proteine Ubx2 und Cdc48 steckengebliebene Vorstufenproteinen aus der Eintrittspforte der Mitochondrien, dem TOM-Komplex, und führen diese dem Abbau durch das Proteasom zu.
Christoph Mårtensson
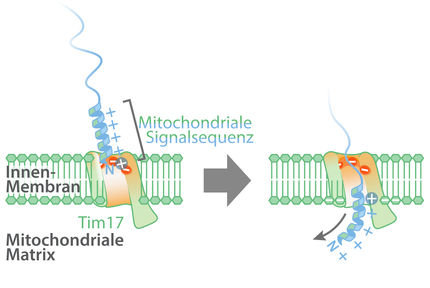
Mitochondrien produzieren den Großteil der Energie für den Zellstoffwechsel, weshalb sie auch als Kraftwerke der Zelle bekannt sind. Dabei sind Mitochondrien auf die Aufnahme von etwa 1.000 verschiedenen Proteinen angewiesen. Diese Proteine werden als Vorstufen im Cytosol, der Zellflüssigkeit, hergestellt. Anschließend werden diese Vorstufenproteine über die zwei Membranen der Mitochondrien transportiert. Molekulare Maschinen, die so genannten Proteintranslokasen, importieren Vorstufenproteine in die Mitochondrien. Die Translokase der Außenmembran der Mitochondrien, kurz TOM-Komplex, bildet dabei die Eintrittspforte für die meisten Vorstufenproteine. Allerdings kann es bei diesem Proteintransport auch dazu kommen, dass Vorstufenproteine im Kanal des TOM-Komplexes hängenbleiben und so den Importweg für weitere Proteine in die Mitochondrien versperren. Defekte im Proteintransport in die Mitochondrien haben verheerende Folgen für das Überleben der Zelle und führen zu einer Reihe von zellulären Stressantworten. Wie die Zelle verhindert, dass die TOM-Komplexe mit Vorstufenproteinen blockiert werden, war bislang unklar.
Forschende aus dem Graduiertenkolleg 2202 „Transport über und in Membranen“ und dem Exzellenzcluster CIBSS – Centre for Integrative Biological Signalling Studies der Universität Freiburg haben einen neuen Mechanismus entdeckt, der steckengebliebene Vorstufenproteine aus dem TOM-Komplex entfernt. Der Doktorand Christoph Mårtensson aus der Arbeitsgruppe von Thomas Becker konnte in Zusammenarbeit mit der Arbeitsgruppe von Prof. Dr. Bettina Warscheid nachweisen, dass das Protein Ubx2 an den TOM-Komplex bindet. Dies war für die Forscher überraschend, da zuvor für Ubx2 eine Rolle beim Abbau von fehlgefalteten Proteinen im Endoplasmatischen Reticulum, also in einer anderen Zellorganelle, beschrieben worden war. Das Team von Thomas Becker konnte zeigen, dass Ubx2 auch in den Mitochondrien vorkommt. Es bildet am TOM-Komplex eine Andockstelle für das cytosolische Protein Cdc48. Cdc48 kann unter Energieverbrauch steckengebliebene Vorstufenproteine aus dem TOM-Komplex herausziehen, welche anschließend durch das Proteasom, die wichtigste Abbaumaschine für Proteine in der Zelle, abgebaut werden.
Die Forscher haben diesen Reaktionsweg „mitochondrial protein translocation-associated degradation“, kurz mitoTAD, genannt. Der mitoTAD-Weg löst die Blockade des Proteinverkehrs am TOM-Komplex auf und erlaubt so einen freien Proteinverkehr in die Mitochondrien. Da Defekte im Proteinimport in die Mitochondrien mit schweren Erkrankungen wie zum Beispiel des Nervensystems in Verbindung gebracht werden, könnte die Entdeckung des mitoTAD-Weges neue Einblicke in die Entstehung dieser Krankheiten liefern.