Wie Stammzellen ein Gehirn korrekter Größe und Zusammensetzung bauen
Zum Aufbau des Neocortex – eines Gehirnareals, das eine wichtige Rolle bei der höheren kognitiven Wahrnehmung spielt – generieren Stammzellen Milliarden Neuronen unterschiedlichen Typs. Neurowissenschafter aus der Schweiz, aus Belgien sowie vom Institute of Science and Technology Austria (IST Austria) konnten nun zeigen, dass die Stammzellen im Neocortex verschiedene Reifestadien durchleben, aus denen jeweils ein anderer Neuronentyp hervorgeht. Die Produktion des korrekten Neuronentyps zum richtigen Zeitpunkt ist an die Funktion eines spezifischen Proteinkomplexes gebunden.
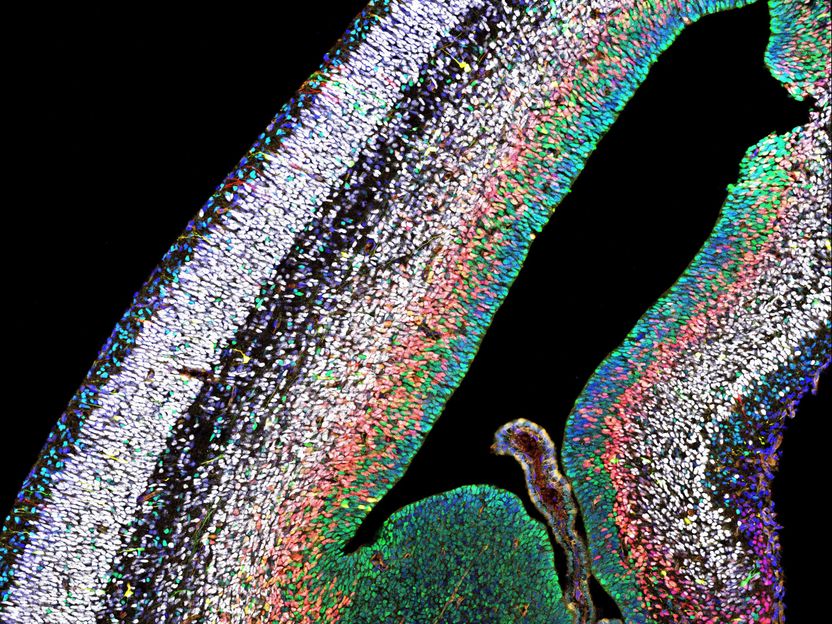
Konfokalmikroskopische Aufnahme des Cortex eines Mausembryos. Grün: Stammzellen; rot: Zwischenstadium; weiß: fertige Neuronen. Blau: Zellkerne.
IST Austria/Hippenmeyer Group
Mit seinen tiefen Furchen und zahlreichen Windungen hat der Neocortex unsere Vorstellung vom menschlichen Gehirn geprägt. In dieser äußersten Schicht der Großhirnrinde tummeln sich trotz ihrer geringen Dicke von wenigen Millimetern bei Erwachsenen über 15 Milliarden Neuronen. Die Informationsverarbeitung im Neocortex ermöglicht es uns, unsere Umwelt bewusst wahrzunehmen. Geht während der Entwicklung des Neocortex etwas schief, können ernsthafte neurologische Störungen wie Autismus oder Schizophrenie die Folge sein. Wie jedoch im Zuge der embryonalen Entwicklung aus Stammzellen eine Gehirnrinde korrekter Zusammensetzung und Größe entsteht, ist nicht vollständig geklärt. Die aktuelle Studie der Wissenschafter rund um Denis Jabaudon von der Université de Genève, Schweiz, und Laurent Nguyen von der Université de Liège, Belgien, sowie der IST Austria-Forschungsgruppe von Professor Simon Hippenmeyer bietet Antworten auf die Frage, wie die Stammzellen des Neocortex jene große Anzahl an Neuronen unterschiedlicher Art und Funktion generieren können, die die neuronale Vielfalt des menschlichen Gehirns ausmacht.
Die Zeit als Maßstab neuronaler Identität
Die Forscher liefern Belege dafür, dass die Stammzellen zu verschiedenen Zeitpunkten mit unterschiedlichen Genexpressions- bzw. Transkriptionsprogrammen ausgestattet sind und diese jeweils spezifischen genetischen „Fingerabdrücke“ an ihre Tochterzellen, also die Neuronen, weitergeben. Die sich laufend ändernden bzw. neu dazugewonnenen Eigenschaften der Stammzellen und Neuronen gehen mit einer zunehmenden Komplexität ihrer Genexpressionsprogramme einher: Während in frühen Stadien Programme dominieren, die vorrangig zellinterne Prozesse wie zum Beispiel den Zellzyklus steuern, nehmen mit steigendem Reifegrad jene Programme zu, die auf äußere Reize angewiesen sind und somit mit der Umgebung interagieren.
Ein Proteinkomplex mit großer Verantwortung
Als Kontrollfaktor dieser zeitlich gebundenen Aktivierung unterschiedlicher Genexpressionsprogramme hatten die Forscher spezifische regulatorische Proteine in Verdacht. Ein Proteinkomplex, der nur in frühen Stammzellstadien stark exprimiert vorliegt, nicht jedoch zu späteren Zeitpunkten, ist der sogenannte Polycomb Repressive Complex 2 (PRC2). Zur Beantwortung der Frage, ob PRC2 tatsächlich die Reifung der Stammzellen steuert, suchten die Schweizer und belgischen Wissenschafter die Zusammenarbeit mit Professor Simon Hippenmeyer und Postdoc Nicole Amberg. Und tatsächlich: Mithilfe genetischer Methoden konnten die IST Austria-ForscherInnen jegliche PRC2-Aktivität während der Neocortex-Entwicklung in der Maus stilllegen und damit die vermutete Funktion des Proteinkomplexes bestätigen.
Protein-Fehlfunktion mit drastischen Folgen
Die Inaktivierung von PRC2 hatte weitreichende Folgen: Die Stammzellen reiften zu schnell und produzierten falsche Neuronentypen zum falschen Zeitpunkt – der reguläre Reifeprozess der Stammzellen war gestört. Hinzu kam, dass die Abwesenheit von PRC2 eine drastische Reduktion der Gesamtzahl an produzierten Neuronen bedingte. In Kombination führten diese Entwicklungen zu Mikrozephalie, also einem zu klein gewachsenen Cortex bzw. Kopf, sowie einer falschen neuronalen Zusammensetzung. Nicole Amberg, die vor Kurzem das Hertha-Firnberg-Programm des FWF für ihre zukünftige Forschungsarbeit zugesprochen bekam: „Die Ergebnisse zeigen einmal mehr, wie komplex und heikel die Entwicklung unseres Gehirns ist. Wir haben nun ein klareres Bild davon, wie neuronale Stammzellen den richtigen Typ und die richtige Anzahl an Neuronen produzieren – und können damit auch jene Strukturen und Mechanismen besser verstehen, die bei Fehlfunktion zu Fehlbildungen im Gehirn eines Embryos und damit zu neuronalen Entwicklungsstörungen führen.“