3D-Filme aus der Zellmembran
Neue Mikroskopietechnik ermöglicht es, Membranproteine bei der Arbeit zu beobachten
Auf die Funktionsweise von Zellen bietet sich nun ein neuer Blick, und der könnte auch Erkenntnisse für die Suche nach neuen Medikamente liefern. Forscher des Max-Planck-Instituts für die Physik des Lichts und des Max-Planck-Zentrums für Physik und Medizin in Erlangen haben eine Methode entwickelt, mit der sich Proteine in der Zellmembran in Echtzeit verfolgen lassen. Dazu markierte das Team die molekularen Akteure mit einzelnen Goldnanopartikeln. Letztere streuen eingestrahltes Licht, woraus die Wissenschaftler die Position der Proteine ableiten können.
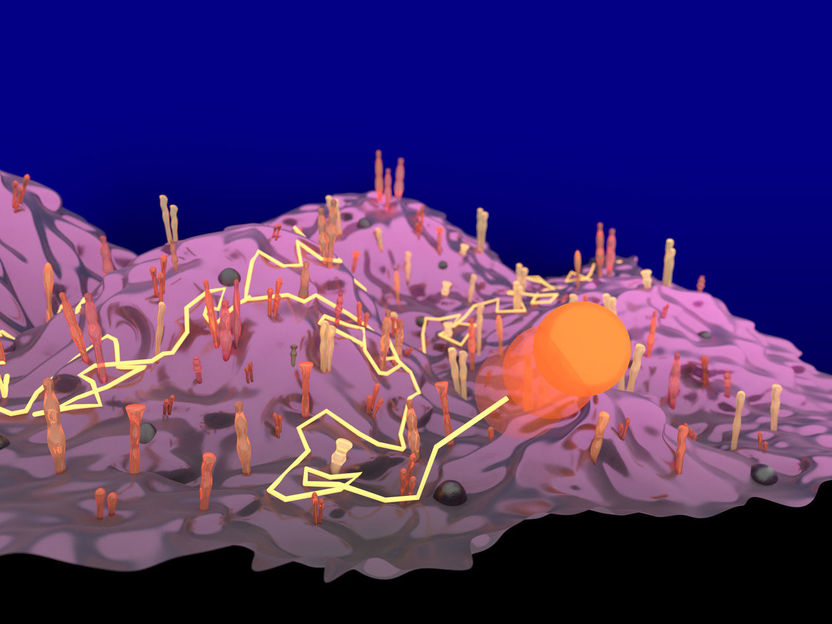
Roadmovie mit Membranprotein: Ein mit einem Goldpartikel (oranger Kreis) markiertes Eiweiß-Molekül lässt sich auf seinem Weg Zelloberfläche verfolgen (hellgelbe Linie), weil das Nanoteilchen Licht auf charakteristische streut.
© Richard W. Taylor/MPI für die Physik des Lichts
Die Membran einer Zelle ist nur wenige Nanometer dick. Gleichwohl ist in dieser extrem dünnen Hülle ordentlich was los: Zahlreiche und ganz unterschiedliche Moleküle, so genannte Membranproteine, tummeln sich hier. Sie beschleunigen, bremsen ab oder prallen aufeinander. Verbünde werden gebildet und wieder aufgelöst. Auf den ersten Blick erscheint das aktionsreiche Treiben chaotisch, doch eigentlich erfüllen die Winzlinge alle einen bestimmten Zweck. Manche kommunizieren mit der Umgebung, andere sind für die Fortbewegung der Zelle oder für deren Energiehaushalt zuständig. Es gibt Proteine, die eine Art Tunnel von außen ins Innere der Zelle bilden und solche, die die Zelle mit der Umgebung verknüpfen. Wieder andere transportieren bestimmte Stoffe von A nach B.
Daher lässt sich aus den Bewegungen und dem Verhalten der Membranproteine viel über die Funktionsweise einer Zelle lernen. Solche Einsichten sind auch medizinisch relevant, weil ein Großteil medizinischer Wirkstoffe an Membranproteinen angreift. Bislang war es Wissenschaftlern allerdings kaum möglich, das Geschehen live zu beobachten. Zu flink bewegen sich die Akteure, um sie mit herkömmlichen hochauflösenden Mikroskopiemethoden verfolgen zu können.
Goldpartikel streuen Licht und werden so lokalisiert
Für die Mikroskopietechnik, die Wissenschaftler des Max-Planck-Instituts für die Physik des Lichts und des Max-Planck-Zentrums für Physik und Medizin in Erlangen nun vorgestellt haben, trifft das jedoch nicht zu. Mit dieser lassen sich die temporeichen Vorgänge in lebenden Zellen in Echtzeit und hoher Auflösung aufzeichnen. Die Forscher markierten dazu Membranproteine jeweils mit einem winzigen Goldpartikel, indem sie es über Bindungsmoleküle an die Proteine ankoppelten: Trifft nun Licht auf das Metall, wird es gestreut, also in verschiedene Richtungen abgestrahlt. Um den Goldpartikel mit Hilfe dieses Streulichts präzise lokalisieren zu können, nutzen die Forscher das Phänomen der Interferenz, also der Überlagerung von Lichtstrahlen. Experten nennen dieses Vorgehen iSCAT-Mikroskopie, wobei iSCAT für „interferometric scattering“ steht – zu deutsch: interferometrische Lichtstreuung. Aus dem entstehenden Muster der Lichtstrahlen lässt sich die Position des Goldpartikels und somit des markierten Proteins auf wenige Nanometer genau bestimmen.
Der leitende Wissenschaftler des Projekts Vahid Sandoghdar und Erfinder der iSCAT-Mikroskopie betont: „Die Technik beherrschen wir bereits seit einiger Zeit – mit hoher Empfindlichkeit.“ Allerdings sei es ein großer Unterschied, die iSCAT-Mikroskopie bei einzelnen isolierten Partikeln oder tatsächlich bei lebenden Zellen anzuwenden. Letzteres stellte das Team vor eine große Herausforderung. „In einer lebenden Zelle gibt es Millionen von winzigen Strukturen im Hintergrund, die auch das Licht streuen. Das macht es sehr schwierig, das schwache Signal eines Goldpartikels zu erkennen.“ Darüber hinaus verändert sich der Hintergrund permanent, da sich die Strukturen innerhalb der Zelle bewegen.
Die molekularen Akteure lassen sich über Stunden verfolgen
Der Doktorand Reza Gholami war dafür verantwortlich, dieses Problem zu lösen: „Wir haben ausgeklügelte Bildanalyse-Verfahren auf Basis der Methoden des maschinellen Lernens entwickelt, womit wir die charakteristische Signatur der Goldnanopartikel innerhalb einer Fülle anderer Signale identifizieren können“, erklärt er. Mittels Hochgeschwindigkeitskameras kann die iSCAT-Methode die Position der Proteine und schließlich ihre dreidimensionale Bahn visualisieren.
Außerdem ist es möglich, die molekularen Akteure über einen langen Zeitraum zu verfolgen – bereits über etliche Minuten sei dies gelungen. „Wir können die Beobachtung in Zukunft allerdings auch über mehrere Stunden ausdehnen“, so Richard Taylor, Erstautor und Postdoktorand in der Gruppe. Mit ihren Fähigkeiten ist die iSCAT-Technik den weit verbreiteten Fluorenz-basierten Abbildungsmethoden deutlich überlegen. Mit Letzteren lassen sich Proteine nur über einen sehr kurzen Zeitraum ablichten, da die dabei eingesetzten Leuchtfarbstoffe rasch ausbleichen. Auch reicht die räumliche Auflösung der Fluoreszenzmikroskopie nicht aus, um die Bewegung eines Proteins in drei Dimensionen nanometergenau aufzuzeichnen.
Aufnahme und Transport von Proteinen in Echtzeit
Die vorgestellte Methode liefert daher einen bislang nicht dagewesenen Einblick in die Nanowelt einer lebenden Zelle – und Antworten zur Funktionsweise dieser scheinbar chaotischen Welt. „Nun können wir die Proteine in Aktion erleben und wichtige zelluläre Vorgänge wie zum Beispiel die Aufnahme oder den Transport von markierten Proteinen in Echtzeit verfolgen“, sagt Ko-Autorin Alexandra Schambony, Professorin im Department Biologie der Friedrich-Alexander Universität Erlangen-Nürnberg (FAU). Auch sei beispielsweise noch vollkommen unklar, wie die Membranproteine mit anderen kleinen Molekülen interagieren oder mit weiteren Proteinen aus der Umgebung, etwa dem Zytoskelett.
Solche zellbiologischen Prozesse auf der Nanoebene könne man nun erforschen – und noch mehr: „In naher Zukunft lässt sich damit das Schicksal einzelner Proteine von Anfang bis Ende verfolgen“, glaubt Sandoghdar. Und womöglich können Wissenschaftler mit Hilfe der Technik künftig auch die Auswirkungen von krankhaften Genmutationen auf die Funktion von Proteinen entschlüsseln. Die Erkenntnisse ließen sich dann wiederum nutzen, um innovative therapeutische Ansätze zu entwickeln. Die hochaufgelösten 3D-Filme aus der Zellmembran könnten so zu einer hilfreichen Quelle für die biomedizinische Forschung werden.