Den Helfern auf der Spur
Forscher identifizieren mithilfe einer neuartigen Methode ein Transportprotein in Mykobakterien
Ein Team um Dr. Claudia Jessen-Trefzer vom Institut für Pharmazeutische Wissenschaften der Universität Freiburg hat erstmals ein Transportprotein in Mykobakterien identifiziert, das für die Aufnahme des Kohlenhydrats L-Arabinofuranose verantwortlich ist. Die Hauptautoren der Studie, Miaomiao Li vom Institut für Pharmazeutische Wissenschaften, Christoph Müller vom Institut für Biochemie und Klemens Fröhlich vom Institut für Molekulare Medizin und Zellforschung der Universität Freiburg, haben dabei eine neue Methode angewendet, die auch künftig die Bestimmung von Transportproteinen in Mykobakterien vereinfachen könnte. Diese Klasse von Proteinen könnte in Zukunft eine zentrale Rolle bei der Entwicklung neuartiger Medikamente gegen Mykobakterien spielen, um Krankheiten wie Tuberkulose beim Menschen zu behandeln.
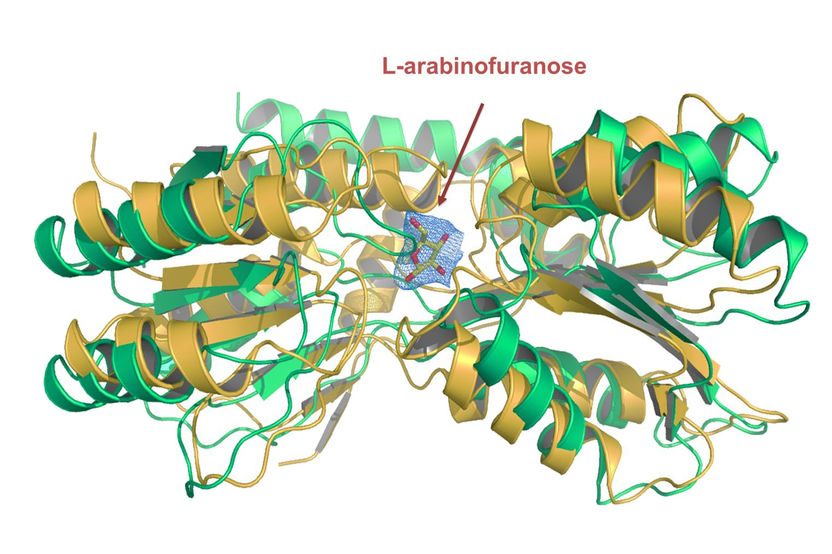
Die Kristallstruktur der Substratbindungsdomäne des Transportproteins, das für die Aufnahme des Nährstoffs L-Arabinofuranose verantwortlich ist.
Claudia Jessen-Trefzer
Transportproteine sitzen in der Membran der Zelle und sind dafür zuständig, Nährstoffe in diese aufzunehmen oder toxische Substanzen aus ihr herauszuschleusen. Sie steuern also Vorgänge, die für die Zelle überlebensnotwendig sind. Bisher ist nur wenig über die Proteine bekannt, da sie aufgrund ihrer chemischen Eigenschaften schwer zu untersuchen sind. Die Freiburger Wissenschaftler haben das identifizierte Protein anhand seines Substrats charakterisiert, also des Nährstoffs L-Arabinose, den das Protein an sich bindet. Als Modellorganismus diente dem Team dabei eine Untergruppe des Bakteriums, das Mykobakterium smegmatis.
Das Team entwickelte eine Methode, bei der es die Genexpression – also das gezielte Ablesen von Genen und das Umschreiben in Proteine – durch das Substrat auslöste. Anschließend untersuchten sie die aus der Membran isolierten Proteine mit dem Verfahren der Massenspektrometrie. So gelang es den Freiburger Forschern auf einfache Weise, Transportproteine zu identifizieren, die für die Aufnahme eines bestimmten Nährstoffs verantwortlich sind. Zudem konnten die Wissenschaftler den L-Arabinofuranose-Transporter bestimmen, dessen Eigenschaften sie unter anderem durch Proteinkristallographie weiter charakterisierten. Die Arbeit des Teams könnte die Identifizierung von Transportproteinen in Mykobakterien stark vereinfachen und dazu beitragen, potenzielle Zielproteine für die Antibiotikaentwicklung zu finden.
Originalveröffentlichung
Miaomiao Li; Christoph Müller; Klemens Fröhlich; Oliver Gorka; Lin Zhang; Olaf Groß; Oliver Schilling; Oliver Einsle; Claudia Jessen-Trefzer; "Detection and characterization of a mycobacterial L-arabinofuranose ABC-transporter identified with a rapid lipoproteomics protocol"; Cell Chemical Biology; 2019.
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Massenspektrometrie
Die Massenspektrometrie ermöglicht es uns, Moleküle aufzuspüren, zu identifizieren und ihre Struktur zu enthüllen. Ob in der Chemie, Biochemie oder Forensik – Massenspektrometrie eröffnet uns ungeahnte Einblicke in die Zusammensetzung unserer Welt. Tauchen Sie ein in die faszinierende Welt der Massenspektrometrie!
Themenwelt Massenspektrometrie
Die Massenspektrometrie ermöglicht es uns, Moleküle aufzuspüren, zu identifizieren und ihre Struktur zu enthüllen. Ob in der Chemie, Biochemie oder Forensik – Massenspektrometrie eröffnet uns ungeahnte Einblicke in die Zusammensetzung unserer Welt. Tauchen Sie ein in die faszinierende Welt der Massenspektrometrie!