Proteinkomplex verhindert toxische Aggregation von Proteinen
Ein Proteinkomplex in der Zelle trägt entscheidend dazu bei, Toxizität bei Proteinen zu verhindern, die sich in amyloiden Plaques ansammeln. Dies kann zu neurodegenerativen Erkrankungen wie Alzheimer und Chorea Huntington führen.
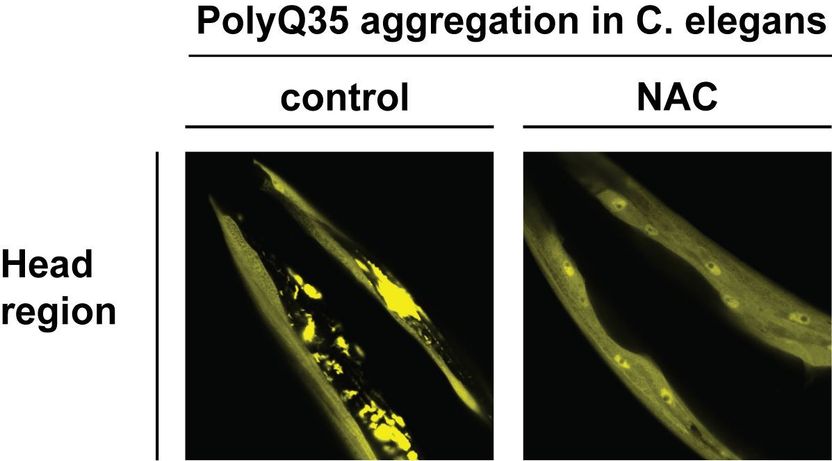
Aggregation of PolyQ35 protein in C. elegans is suppressed by NAC. The images show the head region of worms expressing a Huntington’s disease related polyglutamine-expanded protein (PolyQ35). Overexpression of NAC in the worm (right image) prevents aggregation and toxicity of PolyQ35.
Copyright: Karina Gense
Wissenschaftler der Universitäten Konstanz (Deutschland), Leeds (Großbritannien) und Stanford (USA) haben herausgefunden, dass der Nascent Polypeptide-Associated Complex (NAC) die Aggregation von Proteinen verhindern kann, die in Verbindung mit verschiedenen neurodegenerativen Erkrankungen gebracht werden.
Verheerende neurodegenerative Erkrankungen wie Chorea Huntington und Alzheimer sowie verschiedene spinozerebelläre Ataxien stehen in direktem Zusammenhang mit bestimmten Zellproteinen, die sich in der Zelle strukturell verändern. Diese Proteine bilden schädliche Plaques und verursachen so eine fortschreitende Fehlfunktion und schließlich den Tod neuronaler Zellen im Gehirn.
Die neuen Ergebnisse wurden von einem Team internationaler Wissenschaftler vom Sonderforschungsbereich 969 „Chemical and Biological Principles of Cellular Proteostasis“ der Universität Konstanz (Deutschland), dem interdisziplinären Astbury Centre for Structural Molecular Biology der University of Leeds (Großbritannien), das zum Thema „Life in Molecular Detail“ forscht, sowie den Fachbereichen Biologie und Genetik der Stanford University (USA) vorgelegt.
Bei dem untersuchten Chaperon NAC handelt es sich um einen Proteinkomplex, der in allen eukaryotischen Organismen vorkommt und essentiell für gesunde Zellaktivität ist. Es war bereits bekannt, dass NAC in der Zelle ans Ribosom bindet und so die Produktion neuer Proteine ermöglicht. Erst jetzt wurde von den Forschern herausgefunden, dass der Komplex auch eine Ribosomen-unabhängige Funktion besitzt, die eine grundlegende Rolle bei der Vermeidung zellulärer Degeneration spielt.
Elke Deuerling, Professorin für Molekulare Mikrobiologie an der Universität Konstanz und eine der Lead-Autorinnen der Studie erklärt: „Das Faszinierende daran ist, dass NAC verschiedene Arten von Proteinen erkennen kann, die zur Aggregation neigen, und diese daran hindern kann. Bei NAC handelt es sich um ein besonders häufig vorkommendes zelluläres Protein, das in viele Vorgänge eingebunden zu sein scheint, die die Fitness, Gesundheit und Funktionalität von Zellen gewährleisten. Wir halten es für eines der wichtigsten Chaperone in der Zelle.“
NAC kommt in allen Eukaryoten von der Hefe bis zum Menschen vor und wurde das erste Mal vor über 25 Jahren beschrieben. Seine genauen Funktionen, die für Organismen überlebenswichtig sind, blieben allerdings lange unerforscht. Das aktuelle Paper liefert nun zum ersten Mal eindeutige Beweise dafür, dass NAC auch jenseits des Ribosoms Chaperon-Aktivität bei strukturell verschiedenartigen Substraten ausübt, darunter Polyglutamin (PolyQ)-haltige Proteine und Amyloid-β 40 (Aβ40) Peptide. Besonders wichtig dabei ist, dass NAC PolyQ-Aggregation in vivo unterbindet und die Gesundheit von Organismen fördert, wie Tests mit dem Tiersystem C. elegans ergeben haben, die vom Konstanzer Team – geleitet von Dr. Martin Gamerdinger und Prof. Dr. Elke Deuerling – unter Mitarbeit von Karina Gense, Nadine Sachs und Renate Schlömer durchgeführt wurden.
PolyQ-Analysen in neuronalen Mauszellen wurden von Prof. Dr. Judith Frydman von der Stanford University und ihrem Team, darunter Ko-Erstautorin Dr. Koning Shen, unter Mitarbeit von Rebecca Chan durchgeführt. Diese Analysen zeigen, dass eine Reduktion von NAC zu katastrophalen Schäden in Zellen führt, die toxische Proteine produzieren – ein weiterer Beleg für die essentielle Rolle, die NAC bei der Unterdrückung von Protein-Aggregation spielt.
Das internationale Forscherteam identifizierte die ans Ribosom bindende, positiv geladene Untereinheit N-βNAC, die aus nur 40 Aminosäuren besteht, als diejenige NAC-Dömane, die für die Ausübung der Chaperon-Aktivität jenseits des Ribosoms verantwortlich ist. Die Forscherinnen und Forscher aus Stanford zeigten dabei, dass kleine Peptide innerhalb dieser Sequenz erfolgreich die Ansammlung von krankheitserregenden, Polyglutamin-haltigen Proteinen verhindern können. Das gilt beispielsweise auch für Huntingtin, das zu Chorea Huntington führen kann, sowie für Ataxin-3, das eine Art von Ataxie auslösen kann. „Das war eine große Überraschung für uns“, kommentiert Martin Gamerdinger. „Es bedeutet, dass N-βNAC eine doppelte Rolle zukommt: Es bindet NAC ans Ribosom und unterdrückt jenseits davon die Aggregation von PolyQ-Proteinen.“
Ein wichtiger Meilenstein bei der Erforschung von NAC bestand darin, herauszufinden, wie er zerstörerische Proteine erkennt, bindet und so deren Aggregation verhindert. Ein wichtiger Beitrag wurde in dieser Hinsicht von Prof. Dr. Sheena Radford und ihrem Team, darunter Esther Martin, Antonio Calabrese, Patrick Knight und Katie Stewart, vom Astbury Centre for Structural Molecular Biology der University of Leeds geleistet.
Das Team aus Leeds konnte NAC chemisch mit zwei Proteinsubstraten verknüpfen, bei denen es nachweislich eine toxische Aggregation in der Zelle verhindert: Ataxin-3 und Amyloid-β 40, die in Verbindung mit spinozerebellärer Ataxie respektive Alzheimer gebracht werden. Unter dem Einsatz von Massenspektrometrie fanden die Wissenschaftlerinnen und Wissenschaftler heraus, welche Teile des Chaperons und des Substrats sich miteinander verbinden. Die Ergebnisse sind eindeutig und überraschend: „Eine spezifische Region des NAC-Chaperons bindet Ataxin-3. Wenn man sie isoliert zugibt, reicht das, um eine PolyQ-Aggregation zu verhindern“, erklärt Sheena Radford. „Bei Amyloid-β 40 ist es überraschenderweise so, dass es mindestens noch eine weitere Chaperon-Domäne innerhalb von NAC geben muss, die wir aber erst finden müssen. Ihre Auswirkungen lassen sich eindeutig beobachten – sie verhindert die Protein-Aggregationen komplett. Diese zweite Bindestelle bei Amyloid-β 40 müssen wir allerdings erst noch identifizieren.“
Eine zukünftige Aufgabe wird es sein, weitere bislang unbekannte NAC-Domänen, die Interaktionen mit den Substraten ermöglichen, zu identifizieren. Eine andere ist es, die Ergebnisse dieser Studie für medizinische Anwendungen weiterzuentwickeln. „Die Chaperon-Domäne innerhalb von NAC klar zu identifizieren war ein wichtiger Schritt und ist von größter Bedeutung für die Entwicklung therapeutischer Ansätze für die Behandlung von neurodegenerativen Erkrankungen“, betont Prof. Dr. Judith Frydman. „Die Konzentration von NAC in Zellen zu erhöhen, um Protein-Aggregation zu verhindern, ist leider nicht in allen Fällen förderlich. Die Arbeit mit dem N-βNAC-Fragment – oder mit noch kleineren aus nur 20 Aminosäuren bestehenden Peptiden, die wir innerhalb N-βNAC identifizieren konnten – könnte allerdings den entscheidenden Unterschied machen. Wir sind vielleicht noch nicht in der Lage, Chorea Huntington oder Alzheimer zu heilen. Aber es könnte eventuell möglich werden, wenigstens das Fortschreiten dieser Krankheiten hinauszuzögern.“
Originalveröffentlichung
Koning Shen, Martin Gamerdinger, Rebecca Chan, Karina Gense, Esther M. Martin, Nadine Sachs, Patrick D. Knight, Renate Schlömer, Antonio N. Calabrese, Katie L. Stewart, Lukas Leiendecker, Ankit S. Baghel, Sheena E. Radford, Judith Frydman, Elke Deuerling; "Dual role of ribosome-binding domain of NAC as a potent suppressor of protein aggregation and aging-related proteinopathies"; Molecular Cell; 11. April 2019.