Signifikante Unterschiede zwischen den krebsfördernden Enzymen USP25 und USP28 identifiziert
Neue Wegweiser für Krebsmedikamente
Forscher des Rudolf-Virchow-Zentrums der Universität Würzburg haben die krebsfördernden Enzyme USP25 und USP28 strukturbiologisch charakterisiert und signifikante Unterschiede in deren Aktivität identifiziert. Beide Enzyme fördern das Wachstum verschiedenartiger Tumore. Die Erkenntnisse wurden in der Fachzeitschrift Molecular Cell veröffentlicht und könnten der Entwicklung neuer, nebenwirkungsarmer Krebsmedikamente dienen.
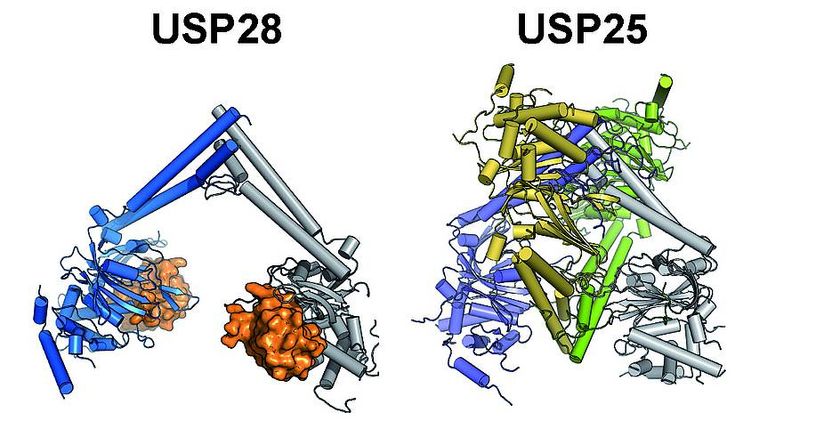
Struktur der katalytischen Domänen von USP28 und USP25: USP28 liegt als Dimer aktiv in der Zelle vor und kann jederzeit sein Substrat Ubiquitin (orange) binden und verarbeiten. USP25 liegt dagegen in der Zelle als Tetramer vor, das sich aus zwei miteinander verschränkten USP28 ähnlichen Dimeren zusammensetzt (blau/grau und gelb/grün). Durch diese 'Verschränkung' wird die Bindung des Substrats verhindert und das Enzym in einem inaktiven Zustand gehalten.
Kisker Group, Rudolf Virchow Center
Das fortwährende Zusammenspiel aus Produktion und Abbau von Proteinen zählt zu den zentralen Steuerungskräften des zellulären Metabolismus. Ein Kernmechanismus dieser Regulation ist die Markierung eines Proteins mit Ubiquitin, einem kleinen Polypeptid, das u.a. als Signal für den Proteinabbau dient. Durch Enzyme aus der Gruppe der Deubiquitinasen kann die Ubiquitinierung rückgängig gemacht und das Protein gerettet werden. Man vermutet, dass in Krebszellen diese gegenläufigen Prozesse aus dem Gleichgewicht geraten. In diesem Zusammenhang sind in den letzten Jahren die Deubiquitinasen als vielversprechende Wirkstoffziele einer zukünftigen Krebstherapie in den Fokus der Wissenschaft gerückt.
Strukturen der katalytischen Domänen enträtselt
Die Studie fokussierte sich speziell auf die Deubiquitinasen USP25 und USP28. Beide Enzyme sind wichtig für die Entwicklung verschiedenartiger Tumore. Die Forschung der beiden Strukturbiologen Dr. Florian Sauer und Theresa Klemm aus der Arbeitsgruppe von Prof. Dr. Caroline Kisker am Rudolf-Virchow-Zentrum liefert wichtige Einblicke in die Struktur und Funktion der beiden Deubiquitinasen USP25 und USP28. Dabei gelang es ihnen, mittels Röntgenkristallographie, die dreidimensionale Struktur der zentralen katalytischen Domänen beider evolutionär nahe verwandten Enzyme zu entschlüsseln und dadurch sowohl Gemeinsamkeiten als auch entscheidende Unterschiede zwischen beiden Proteinen aufzudecken.
„Überraschende Erkenntnisse dabei waren, dass USP25 trotz seiner strukturellen Ähnlichkeit zu USP28 sowohl in isolierter Form, als auch in Zellen inaktiv ist und dass es einen Zusammenhang zwischen dem oligomeren Zustand und seiner Aktivität gibt.“, schildert Sauer. Die Analyse der Forscher zeigte, dass das inaktive USP25 ein Tetramer bildet, also einen aus vier Untereinheiten aufgebauten Molekülkomplex. Das aktive USP28 hingegen liegt als Dimer vor, es besteht also aus zwei identischen Untereinheiten. „Durch einfügen von Veränderungen, sog. Mutationen, die in Krebszellen gefunden wurden, konnten wir zeigen, dass das USP25 Tetramer in zwei USP28-artige Dimere zerfällt und damit die Selbsthemmung des Enzyms aufgehoben wird.“, berichtet Klemm.
Neue Wegweiser für Krebsmedikamente
Dieses Wissen kann nun in die weitere Forschung an spezifisch wirksamen, und somit nebenwirkungsarmen Krebsmedikamenten einfließen. „Zum einen wurden neue Ansatzpunkte erkannt, die beispielsweise dazu dienen können, maßgeschneiderte Wirkstoffe zu entwickeln, die nur USP28 adressieren und dabei das für die Immunantwort so wichtige USP25 aussparen“, sagt Sauer. „Zum anderen scheint es bei der Medikamentenentwicklung sinnvoll zu sein, auf eine Behinderung der Aktivierung des an sich inaktiven USP25 abzuzielen“, ergänzt Klemm.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte

Triggerpunkte für Darmkrebs in jungen Lebensjahren gefunden - Regenerative Stammzellen als Ursprung entzündungs-assoziierter Darmtumore
Paul_Greengard

Analytica 2022: Mit vereintem Know-how gegen COVID-19 - Neue Werkzeuge der Virenforschung und -detektion

Amferia schließt Investition von 1,2 Millionen Euro zur Bekämpfung resistenter bakterieller Infektionen ab - "Bakterielle Infektionen werden in Zukunft wahrscheinlich Krebs und Herzkrankheiten als Haupttodesursache beim Menschen ablösen..."

KI-Einsatz stagniert in deutschen Unternehmen - Forschung und Entwicklung nutzt KI am häufigsten zur Analyse und Modellierung von Daten
Novartis macht Fortschritte bei Biosimilar-Strategie

Bristol Myers Squibb verlängert Proteomik-Partnerschaft mit Evotec
Weiße, rote und blaue Signale warnen Sie vor gefährlichen Keimen! - Eine einfache, schnelle Methode zur gleichzeitigen Identifizierung mehrerer Bakterien im Zusammenhang mit Lebensmittelvergiftungen

Wein, Blut und Motoröl – ein Sensor für viele Flüssigkeiten
Paul_Nurse