Wie Noroviren ihre Vorliebe für Süßes kontrollieren
Neu entdeckter Mechanismus in der Virushülle bedeutsam für die Entwicklung von Impfstoffen
Forscher aus dem Institut für Chemie und Metabolomics der Universität zu Lübeck haben einen neuen Mechanismus entdeckt, mit dem humane Noroviren Zuckerbindung „abschalten“ können. Den Schlüssel zu diesen neuen Erkenntnissen lieferte die NMR-Spektroskopie (Nuclear Magnetic Resonance; Kernresonanzspektroskopie). Sowohl die Entwicklung von Impfstoffen wie auch die Suche nach antiviralen Substanzen sollten von dieser Entdeckung profitieren.
Die Forscher Dr. Alvaro Mallagaray und Robert Creutznacher aus der Arbeitsgruppe um Prof. Dr. Thomas Peters (Direktor des Instituts für Chemie und Metabolomics) stießen bei ihren NMR-spektroskopischen Experimenten mit viralen Hüllproteinen auf eigenartige Veränderungen, die zunächst nicht zu erklären waren. Vorhergehende Studien in Lübeck wie auch in anderen Laboratorien weltweit hatten keine Hinweise auf eine Transformation des Hüllproteins geliefert.
Die ungewöhnliche Beobachtung wurde möglich, weil es den Forschern in aufwendigen Vorarbeiten in den vergangenen Jahren gelungen war, die viralen Hüllproteine auf eine spezielle Art mit nicht-radioaktiven Isotopen zu markieren und so den NMR-spektroskopischen Fingerabdruck der Proteine nahezu vollständig zu entschlüsseln. Mit der Entschlüsselung dieses Fingerabdrucks ist es nun möglich, tiefen Einblick in die Anheftung der viralen Hüllproteine an Zuckerstrukturen auf der Oberfläche von Wirtszellen und von Bakterien, die Bestandteil des sogenannten Mikrobioms im Darm sind, zu gewinnen.
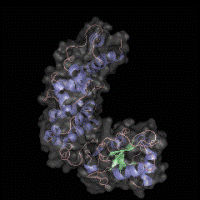
Die Anheftung humaner Noroviren an ganz bestimmte Zuckerstrukturen, die sogenannten humanen Histoblutgruppenantigene (HBGAs), wird als entscheidender Schritt für eine erfolgreiche Infektion angesehen und ist deshalb Gegenstand einer Vielzahl von Studien, die für die Entwicklung antiviraler Hemmstoffe auf die Inhibierung dieser spezifischen Wechselwirkung zwischen Virus und Wirt abzielen.
Die Ursache der von Mallagaray und Creutznacher beobachteten Veränderungen offenbarte sich gewissermaßen als Nebenprodukt der Entschlüsselung des Protein-Fingerabdrucks in einem aufwendigen dreidimensionalen NMR-Experiment, einem sogenannten HN(CO)CACB-NMR Experiment. Die spektralen Daten zeigten an, dass ein Aminosäurerest, der die Zucker-Bindungsstelle flankiert, einer relativ raschen spontane Umwandlung unterliegt und so die Zuckerbindung signifikant unterdrückt. Derartige Prozesse sind als posttranslationale Modifikationen grundsätzlich seit langem bekannt, jedoch noch nie mit Virusinfektionen und der Wechselwirkung viraler Hüllproteine mit Wirtszellfaktoren oder Rezeptoren in Verbindung gebracht worden.
Die Ergebnisse aus dem Lübecker Labor wurden mit Hilfe komplementärer Experimente in anderen Arbeitsgruppen im Rahmen einer Kooperation unter dem Dach der von der Deutschen Forschungsgemeinschaft (DFG) geförderten Forschergruppe ViroCarb bestätigt. So konnte die Arbeitsgruppe um Dr. Charlotte Uetrecht vom Heinrich-Pette-Institut in Hamburg die Befunde massenspektrometrisch untermauern, und der Gruppe um Dr. Bärbel Blaum von der Universität Tübingen ist es gelungen, die strukturellen Details der geänderten Glycanbindung mit Hilfe der Röntgenkristallographie aufzuklären.
Eine Analyse der Gensequenzen von derzeit in Epidemien prävalenten Norovirusstämmen zeigt, dass ca. 60 Prozent der Viren diese posttranslationale Modifikation ausbilden können und damit die Bindung an Zuckerketten auf Wirtszell- oder Bakterienzelloberflächen modulieren. Es ist derzeit noch unklar, ob und welchen Vorteil das Virus bei der Infektion von dieser spontanen Transformation hat. Unstrittig ist allerdings, dass die spontane Umwandlung in der Zucker-Bindungsstelle des Virus bei der Suche nach viralen Hemmstoffen wie auch bei der Entwicklung von Impfstoffen beachtet werden muss.
Originalveröffentlichung
Mallagaray, A., Creutznacher, R., Dülfer, J., Mayer, P.H.O., Grimm, L.L., Orduña, J.M., Trabjerg, E., Stehle, T., Rand, K.D., Blaum, B.S., Uetrecht, C., and Peters; "T. A post-tranlational modification of human Norovirus capsid protein attenuates glycan binding"; Nature Communications; 2019