Perfektionierte Bindetasche
Gerichtete Evolution eines Designer-Enzyms mit unnatürlicher katalytischer Aminosäure
Die Umsatzgeschwindigkeiten natürlicher Enzyme sind beeindruckend hoch. Sie resultieren unter anderem aus einer Verstärkung der katalytischen Aktivität einer Reihe bestimmter Seitenketten von Aminosäuren durch deren präzise Positionierung innerhalb einer Proteinbindungstasche. Niederländische Wissenschaftler zeigen jetzt, dass ein solches Fein-Tuning auch für „Designer-Enzyme“ mit unnatürlichen katalytischen Aminosäuren möglich ist. Wie sie in der Zeitschrift Angewandte Chemie berichten, führte die „Evolution im Labor“ eines Designer-Enzyms mit einer abiotischen Anilin-Seitenkette zu Varianten mit wesentlich höherer Aktivität.
© Wiley-VCH
Die Geschwindigkeiten und Selektivitäten, mit denen Enzyme in der Natur ihre Umwandlungen katalysieren, sind beneidenswert. Um auch nichtnatürlichen Reaktionstypen katalytisch auf die Sprünge zu helfen, ahmen Forscher Enzyme mithilfe von Proteingerüsten nach, die durch ein computergestütztes Protein-Design realisiert werden. Um diese weiter zu optimieren, werden die Darwinschen Prinzipien herangezogen: Durch wiederholtes Durchlaufen eines iterativen Zyklus aus 1) Diversifizieren durch Mutationen, 2) Identifizieren verbesserter Katalysatoren und 3) Vervielfältigen der effizienteren Varianten lassen sich Designer-Enzyme mit sehr hohen Aktivitäten erhalten.
Die Forscher um Clemens Mayer und Gerard Roelfes von der Universität Groningen (Niederlande) konnten jetzt zeigen, dass eine solche gerichtete Evolution auch eine Methode ist, um die Leistungsfähigkeit einer neuartigen Klasse von Designer-Enzymen zu verstärken: Enzymen, die eine nicht in der Natur verwendete Aminosäure als katalytische Gruppe enthalten.
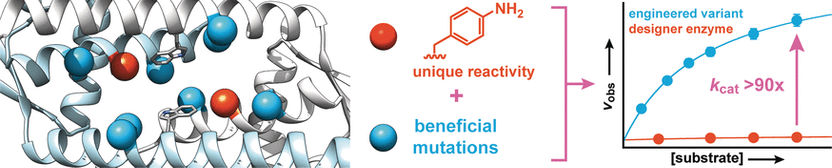
Die Forscher hatten ausgehend von einem Protein aus Lactococcus lactis, einem bei der Herstellung von Milchprodukten wie Käse und Buttermilch verwendeten Bakterium, ein Designer-Enzym hergestellt, das eine Aminosäure mit einer abiotischen Anilin-Seitenkette (Amino-Phenylalanin) enthält. Genau wie freies Anilin katalysiert diese eine Reaktion von Aldehyden mit Hydrazinen oder Hydroxilaminen zu Hydrazonen bzw. Oximen.
Um die Aktivität des Enzyms zu verstärken, erzeugten die Forscher Enzym-Varianten mit Mutationen an Aminosäuren in der Nähe der Anilin-Seitenkette. Ein Screening von ca. 400 Mutanten brachte zwei Treffer mit verbesserter Aktivität, von denen einer in die zweite Evolutionsrunde geschickt wurde. Dabei wurden weitere günstige Mutationen gefunden. Um synergetische Effekte zu identifizieren, wurden mehrere günstige Mutationen kombiniert und weitere Varianten erzeugt. So gelang es, die Umsatzgeschwindigkeit des Enzyms um mehr als das 90fache zu steigern.
„Diese drastische Zunahme basiert auf einer Verstärkung der inhärenten katalytischen Aktivität der Anilin-Seitenkette – ähnlich wie bei natürlichen Enzymen“, berichten die Forscher. „Nach diesem Prinzip wollen wir weitere organische Katalysatoren als Seitenketten in Enzyme einbringen und diese mithilfe einer gerichteten Evolution in hochwirksame Designer-Enzyme umwandeln, die synthetisch relevante Reaktionen, die sonst nur sehr langsam ablaufen, rasch und effizient durchführen.“
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.






















































