Fehlerhafte DNA-Reparatur in Darm-Stammzellen führt zu Krebs
Eine Studie des Exzellenzclusters Entzündungsforschung findet einen neuen Mechanismus wie DNA-Reparatur das Genom schützt und die Entstehung von Darmkrebs verhindert.
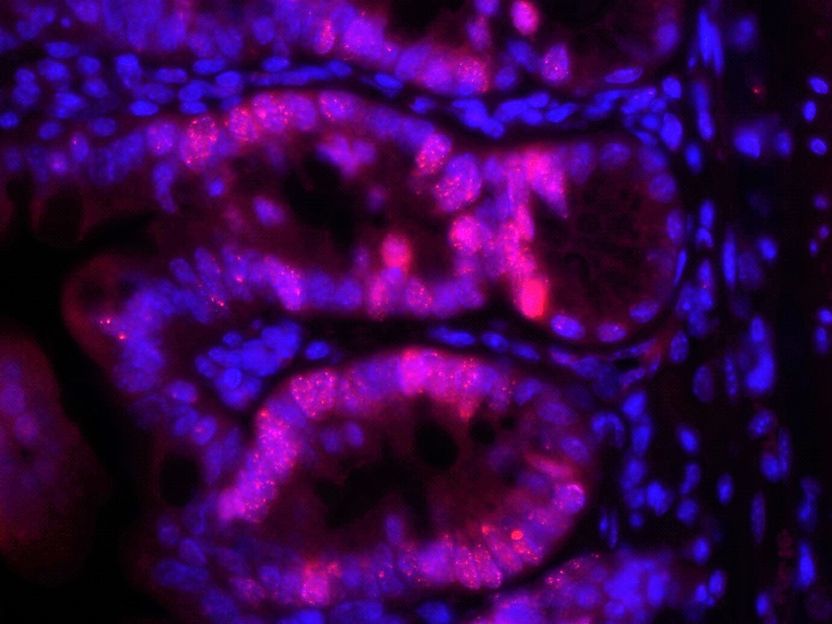
Dünndarmschleimhaut, hier mit 400facher Vergrößerung unter dem Mikroskop. Rot angefäbrt sind Zellen der Darmschleimhaut (intestinale Epithelzellen), die DNA Schäden entwickeln, weil ihnen das Reparaturenzym RNase H2b fehlt.
Konrad Aden/IKMB
Krebs geht von körpereigenen Zellen aus, die sich verändern und beginnen unkontrolliert zu wachsen. Beim Darmkrebs betrifft dies die Zellen der Darmschleimhaut. Ausgangspunkt sind Mutationen, das heißt Veränderungen in der Erbinformation (DNA) der intestinalen Stammzelle. Deren Aufgabe ist es, die Zellen der Darmschleimhaut regelmäßig zu erneuern. Intestinale Stammzellen müssen ihre Teilungsfähigkeit ein Leben lang behalten und sind dadurch besonders empfänglich für Mutationen. Zum Schutz vor DNA-Schäden verfügen sie über spezialisierte Reparaturmechanismen, die Fehler bei der Zellteilung umgehend korrigieren. Die mit Abstand häufigste Ursache für DNA-Schäden ist der fälschliche Einbau eines RNA-Bausteins anstelle des DNA-Bausteins. Diesen millionenfach auftretenden Fehler repariert normalerweise das Enzym RNase H2b, dessen Schutzfunktion schon länger bekannt ist. Unklar war bisher jedoch, ob eine Fehlfunktion des Reparaturenzyms die Krebsentstehung begünstigt. Belege dafür findet eine in Gastroenterology publizierte Studie der Arbeitsgruppe um Cluster-Vorstandsmitglied Professor Philip Rosenstiel und Dr. Konrad Aden vom Institut für Klinische Molekularbiologie (IKMB) der Christian-Albrechts-Universität zu Kiel (CAU) und der Klinik für Innere Medizin I am Universitätsklinikum Schleswig-Holstein, Campus Kiel (UKSH). Sie haben im Mausmodell einen neuen Mechanismus für die Entstehung von Darmkrebs aufgedeckt. Einiges spricht dafür, dass diese Entdeckung auch für Krebserkrankungen bei Menschen relevant ist.
Im Mittelpunkt der Studie stand das Schlüsselenzym der RNA/DNA-Reparatur, die RNase H2b. Dieses Enzym ist besonders dann aktiv, wenn sich Zellen stark vermehren, also proliferieren, zum Beispiel in der Heilungsphase nach Verletzungen oder Entzündungen. Um die Rolle des Enzyms im Zusammenhang mit der Krebsentstehung zu untersuchen, wurden die RNase H2b in Zellen der Darmschleimhaut von Mäusen genetisch ausgeschaltet und die Folgen dieses Eingriffs nach einem Jahr analysiert. Die Tiere entwickelten spontane DNA-Schäden im intestinalen Epithel. Als molekulare Antwort auf die DNA-Schäden kam es zu einer drastischen Verminderung der Stammzellaktivität. „Ohne diesen Reparaturmechanismus stellt die Stammzelle ihre Zellteilung nahezu vollständig ein, so als ob sie sich davor schützen wollte, weiter DNA-Schäden zu produzieren“, sagt Erstautor Dr. Konrad Aden.
Weiterführende genetische Analysen ergaben, dass die Funktion der RNase H2b von dem sogenannten p53 Gen abhängt. Wenn bei den Tieren zusätzlich auch dieses Gen ausgeschaltet ist, kommt es zu einem gegenteiligen Effekt. Die intestinalen Stammzellen fangen an sich unkontrolliert zu teilen. Alle 20 untersuchten Tiere entwickelten, ohne weiteren Einfluss von außen, Darmkrebs. Mit innovativen Sequenziermethoden, die im neu an der CAU geschaffenen Competence Center for Genome Analysis (CCGA) erfolgten, konnten die Schäden im Erbgut genauer charakterisiert werden. „Unsere Ergebnisse weisen darauf hin, dass das Ausschneiden von RNA-Bausteinen ein essentieller Mechanismus ist, um das Erbgut vor DNA-Schäden zu schützen. Das Fehlen dieses Mechanismus hinterlässt, ähnlich einem Fingerabdruck, in der veränderten Buchstabenfolge eine Mutationssignatur, wie sie auch bei Tumoren im Menschen auftritt“, erklärt Professor Philip Rosenstiel, Sprecher des CCGA und Direktor am IKMB.
Zwei weitere Befunde der Arbeitsgruppe lassen den Rückschluss zu, dass der neu entdeckte Mechanismus auch für die Krebsentstehung bei Menschen relevant sein könnte. Erstens: Mutationen des RNase H2b Gens, die bei Personen mit Darmkrebs identifiziert wurden, gehen mit einer verminderten Reparaturfähigkeit einher. Zweitens: Eine niedrige RNase H2b Genexpression, also eine geringe Aktivität des Gens, ist mit einer verkürzten Lebensdauer von Darmkrebskranken verbunden. „Diese Arbeit zeigt erstmalig, dass die gestörte Entfernung von fälschlich eingebauten RNA-Bausteinen aus dem Erbgut ein bislang unbeachteter Mechanismus für die Entstehung von Darmkrebs ist. Es gilt jetzt harauszufinden, ob diese Erkenntnisse für die Prävention oder Behandlung der Erkrankung genutzt werden können“, betont Cluster-Sprecher Professor Stefan Schreiber, Direktor der Klinik für Innere Medizin I am Universitätsklinikum Schleswig-Holstein, Campus Kiel.





















































