Warum Fresszellen in gesundem Gewebe fasten
ETH-Wissenschaftler zeigten, dass die Fresszellen des Immunsystems nicht nur biochemisch, sondern auch mechanisch reguliert werden. Dies könnte erklären, warum die Zellen in gesundem Körpergewebe weniger aktiv sind.
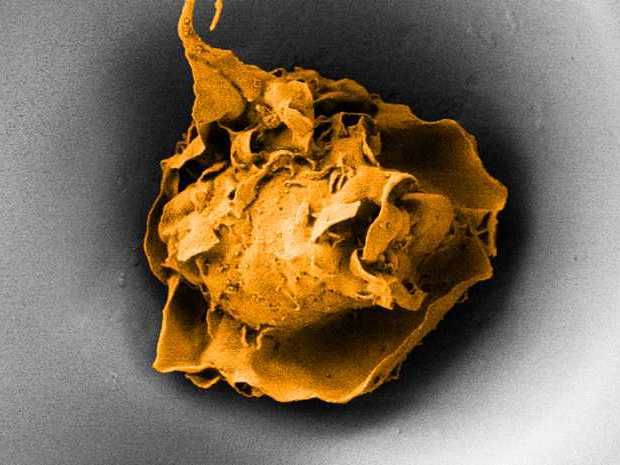
Ein Makrophage in einer Pore mit 20 Mikrometer Durchmesser (Elektronenmikroskopische Aufnahme).
ETH Zürich / Nikhil Jain und Isabel Gerber
Makrophagen sind ein Typ von weissen Blutzellen. In unserem Körper stehen sie unter anderem als «Fresszellen» im Einsatz: Sie spüren bakterielle Krankheitserreger auf, verleiben diese ein und setzen eine Entzündungsreaktion in Gang, welche den Infektionsherd bekämpft. Reguliert werden die Makrophagen von Botenstoffen und anderen biochemischen Substanzen. Diese Moleküle sorgen dafür, dass die Makrophagen bei Bedarf ihre Aktivität hochfahren und nach getaner Arbeit wieder herunter.
Viola Vogel, Professorin am Departement Gesundheitswissenschaften und Technologie, und ihr Postdoktorand Nikhil Jain haben nun einen neuen Weg entdeckt, wie die entzündungsfördernden Makrophagen reguliert werden: über räumliche Information. Wenn Makrophagen im Gewebe zwischen anderen Zellen sitzen und von diesen eingeengt werden ist ihre Aktivität gedämpft, und zwar selbst dann, wenn hochregulierende Botenstoffe vorhanden sind.
Keine unnötigen Entzündungsreaktionen
«Makrophagen zirkulieren nicht nur im Blut, sondern sitzen auch in allen möglichen Geweben. Quasi als Wächter warten sie dort, bis sie gebraucht werden», erklärt Vogel. Für den Körper sei es sehr wichtig, dass sich Makrophagen in intaktem Gewebe ruhig verhalten, andernfalls käme es zu unnötigen Entzündungsreaktionen. «Erst wo Gewebe geschädigt wird, müssen Makrophagen aktiv werden.» Was die entzündungsfördernde Reaktion der Makrophagen in gesundem Gewebe dämpft, habe man bisher nicht voll verstanden.
Dass diese Fresszellen nicht nur biochemisch, sondern auch mechanisch reguliert werden, schliessen die ETH-Wissenschaftler aus Zellkulturexperimenten im Labor. Sie verwendeten dazu unter anderem spezielle Zellkulturschalen mit porenähnlichen Vertiefungen, in denen die Zellen einzeln eingesperrt wurden.
Diese Experimente erlaubten es den Forschenden auch, den dahinterliegenden molekularen Mechanismus zu entschlüsseln. Die Funktion eines Makrophagen ist nämlich an seine Grösse gekoppelt: Wird seine Funktion hochreguliert, wächst er, indem sein Zellskelett erweitert wird. Dies setzt Faktoren frei, welche die Aktivität der Gene beeinflussen. Wird der Makrophage hingegen von aussen eingeengt, kann er nicht wachsen.
Krankheiten verstehen und Implantate verbessern
Die neue Erkenntnis, dass räumliche Faktoren die Aktivierung von Makrophagen steuern, hat Auswirkungen auf das Verständnis verschiedener Krankheiten. «Es gibt eine Reihe von Leiden, die dadurch verursacht werden, dass der Körper Makrophagen ungenügend unter Kontrolle hält und diese Zellen entzündungsfördernde Botenstoffe produzieren», erklärt Vogel. Zu diesen Krankheiten gehörten Rheuma, Arteriosklerose, Fettleibigkeit, Krebs und einige Autoimmunerkrankungen.
Ausserdem führe die Erkenntnis zu neuen Ideen, wie die Oberflächen von Implantaten strukturiert werden könnten, um Entzündungen zu reduzieren, sagt Vogel. «Wir zeigen, dass die Oberflächenstruktur eines Materials die Reaktion von Makrophagen beeinflusst.» Nun könne man zum Beispiel der Frage nachgehen, ob bei Implantaten mit porösen Oberflächen weniger Narbengewebe darum gebildet wird, worauf es bereits erste Hinweise gebe.