Proteinveränderungen weisen auf Krebs hin
UZH-Forschende können erstmals die Proteinmodifikationen exakt und für sämtliche Eiweisse einer Gewebeprobe charakterisieren. Die Veränderungen, die eine typische Reaktion auf Stress sind, geben Aufschluss über den Zustand einer Zelle. Gemeinsam mit dem USZ testen sie nun die neue Methode, um Krebs zu diagnostizieren und zu behandeln.
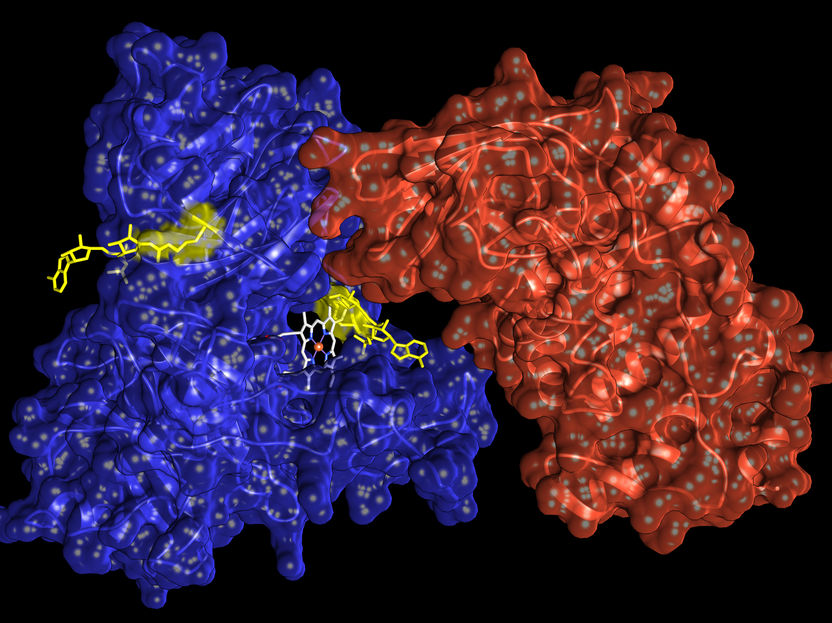
ADP-Ribosylierung von Hemopexin: Das Enzym ARTC1 (rot) modifiziert Hemopexin (blau) an spezifischen Stellen durch Anbringen von ADP-Ribose (gelb) und beeinträchtigt so die Bindungsstärke von Häm (weiss).
Kapila Gunasekera, UZH
Zellen benutzen verschiedene Signale, um auf Stress zu reagieren und andere Körperzellen zu informieren. Auslöser sind etwa Krebs oder entzündliche Erkrankungen. Ein zentraler Signalweg der Stressantwort ist die Modifikation von Proteinen namens ADP-Ribosylierung. Dabei werden an exakt definierten Stellen von Eiweissen kleine Moleküle (ADP-Ribose) angefügt, welche die Proteinfunktion steuern.
Sämtliche Proteinmodifikationen einer Probe bestimmen
Forschende des Instituts für Molekulare Mechanismen bei Krankheiten der Universität Zürich haben nun eine Methode entwickelt, mit der sie zum ersten Mal in Gewebeproben alle Proteine ausserhalb der Zellen, die eine ADP-Ribosylierung als Modifikation tragen, untersuchen können. Mit der Bestimmung dieses sogenannten ADP-Ribosyloms werden auch die genauen Positionen ermittelt, wo die Eiweisse modifiziert wurden. Diese Daten erlauben Rückschlüsse auf aktivierte Signalwege in den Zellen.
Konkret haben die Wissenschaftler Zellen des Muskelgewebes von Mäusen untersucht. Praktisch nur in diesen Geweben ist das Enzym ARTC1 zu finden, das ausschliesslich Proteine verändert, die sich ausserhalb der Zellen befinden. Überraschend war, dass bereits bei Zellen und Geweben ohne Stress ein grosser Teil der extrazellulären Muskeleiweisse die Modifikation aufweist. Im Zellinnern wird die ADP-Ribosylierung hingegen erst in Stresssituationen ausgelöst. «Dies deutet darauf hin, dass ADP-Ribosylierung auf noch unbekannte Weise in viele Signalwege involviert ist und mehrere Möglichkeiten hat, Zellfunktionen zu steuern», sagt Mario Leutert, Erstautor der Publikation.
Krankheiten erkennen anhand veränderter Proteine
Die Wissenschaftler vermuten, dass diese Proteinmodifikationen auch in Krankheitsprozessen involviert sind. Substanzen, die die ADP-Ribosylierung blockieren, wirken gegen bestimmte Formen von Brust- und Eierstockkrebs und können Entzündungen eindämmen. Da nun die Veränderungen aller Proteine in einer Gewebeprobe auf einmal untersucht werden können, lassen sich die Modifikationen an ausgewählten Proteinpositionen in gesunden und kranken Individuen untersuchen. Veränderte ADP-Ribosylierungsmuster weisen auf eine Erkrankung hin und ermöglichen Rückschlüsse auf therapeutische Strategien.
Neue diagnostische und therapeutische Möglichkeiten
Die Gruppe von Michael Hottiger hat zudem den ersten Antikörper entwickelt, der ein einfach ADP-ribosyliertes Protein erkennt. «Erste Ergebnisse in Zusammenarbeit mit dem Universitätsspital Zürich zeigen, dass solche Antikörper für die Prognose des Krankheitsverlaufs bei gewissen Krebsformen dienen könnten», sagt Hottiger. Aktuell entwickeln die Forschenden weitere Antikörper gegen ausgewählte ADP-Ribosylierungsstellen, die in der neuen Studie entdeckt wurden.
Untersuchen möchten sie auch, ob solche Antikörper auch ein therapeutisches Potenzial haben – beispielsweise gegen Krebs. «Wir haben noch viel über die ADP-Ribosylierung zu lernen. Aber wir sind überzeugt, dass der medizinische Nutzen bei Krebs, Infektionen und neurodegenerativen Erkrankungen enorm sein wird», schliesst Hottiger.
Originalveröffentlichung
Mario Leutert, Stephan Menzel, Rickmer Braren, Björn Rissiek, Ann-Katrin Hopp, Kathrin Nowak, Lavinia Bisceglie, Peter Gehrig, Hui Li, Anna Zolkiewska, Friedrich Koch-Nolte, and Michael O. Hottiger; "Proteomic Characterization of the Heart and Skeletal Muscle Reveals Widespread Arginine ADP-Ribosylation by the ARTC1 Ectoenzyme"; Cell Reports; August 14, 2018.























































