Ein Gehirntumor aus der Petrischale
Ein neuartiges Modellsystem für Hirntumore
Gehirntumore gehören zu den aggressivsten und tödlichsten Krebserkrankungen. Vor allem bei jungen Menschen zählen sie zu den häufigsten Tumorneuerkrankungen. Besonders gefürchtet ist das Glioblastom, das sich durch ein sehr rasches Tumorwachstum auszeichnet und sehr schwer zu behandeln ist. Mittlerweile weiß man, dass Gehirntumoren durch eine Vielzahl verschiedener Mutationen in Kombination mit äußeren Faktoren ausgelöst werden. In den letzten Jahren haben riesige Krebsgenom-Sequenzierungsprojekte Tausende von Mutationen katalogisiert, die in Patiententumoren gefunden wurden. Schließlich sind es jene Mutationen, die darüber entscheiden, ob sich gesunde Zellen über kurz oder lang zu Krebszellen entwickeln, die schließlich wuchern, gesundes Gewebe verdrängen und sich systemisch ausbreiten. Bis dato fehlte den WissenschaftlerInnen ein geeignetes Model, um die Wirkung dieser Mutationen im menschlichen Gehirn zu erforschen.
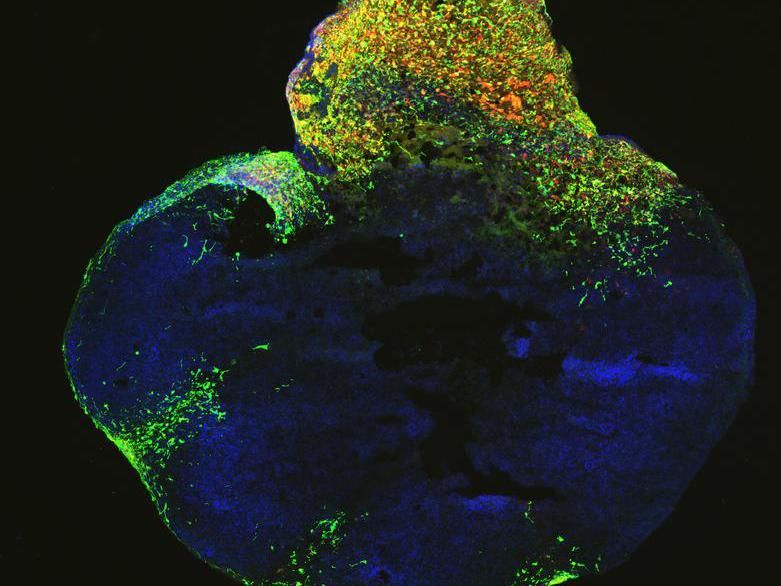
Neoplastisches Gehirn-Organoid mit GFP-positiven Tumorregionen (grün), das eine Glioblastom-ähnliche Zellularität aufweist.
IMBA
Die am IMBA erstmals entwickelten Gehirn-Organoide könnten nun auch für die Krebsforschung eine treibende Rolle spielen. Die Forschungsgruppe rund um Jürgen Knoblich hat kürzlich ein neues Modellsystem für Hirntumoren entwickelt. Das Novum: Die neue Technologie erlaubt es den ForscherInnen, den Prozess der Krebsentstehung im Gehirn nun in der Petrischale nachzuspielen. Die ForscherInnen können dadurch praktisch dabei zusehen, wie dem Organoid ein Tumor wächst.
Neues Modelsystem für die Krebsforschung
Die Forschungsgruppe berichten über die neuen „neoplastischen Gehirn-Organoide“, die sie zur Untersuchung von Gehirntumoren entwickelt haben. "Diese kleinen Organoide reproduzieren einzigartige Aspekte des menschlichen Gehirns detailgetreu, wie z. B. seine verschiedenen Zelltypen und Entwicklungsstadien. Sie erlauben uns daher, die Art und Weise, wie Tumoren entstehen, nachzuvollziehen und bieten ein System, um neue Therapien zu erproben,“ so Jürgen Knoblich, Interimistischer Wissenschaftlicher Direktor am IMBA und Letztautor der Studie.
Mutationen sind genetischen Defekte, die durch natürliche Fehler beim Kopieren von DNA oder durch die Aktivität von Krebsgenen entstehen oder andere Ursachen haben. Sie lösen bei gesunden Zellen schwerwiegende Veränderungen aus, die dazu führen, dass sie außer Kontrolle geraten und sich erstaunlich schnell teilen. Doch jedes Mal, wenn sich eine solche Zelle teilt, kann sie neue Mutationen erzeugen, was die WissenschaftlerInnen vor ein Rätsel stellt. "Einige dieser Mutationen sind Triebkräfte in Tumoren, sie entscheiden, ob Krebs entstehen wird", sagt Shan Bian, Erstautor der Studie, "andere sind einfach Nebenwirkungen. Diese unterschiedlichen Mutationen in menschlichem Gewebe gezielt zu erfassen, war bis dato ein Problem."
Mutationen kartieren und Medikamente testen
Die neuentwickelten neoplastischen Organoide bieten ein unglaubliches Potenzial, diesen Fragen systematisch nachzugehen. Durch moderne Genom-Editing Systeme wie etwa CRISPR / Cas9 und sogenannte Sleeping Beauty Transposons werden Mutationen, die häufig bei Krebspatienten gefunden werden, in die Zellen gebracht. So können einzelne Gene oder Genkombinationen geändert werden, manche Gene werden abgeschaltet während die Aktivität von anderen Genen erhöht wird, und zwar unabhängig von bekannten Gendefekten. So wollen die ForscherInnen zwischen krebsauslösenden und weniger gravierenden Mutationen unterscheiden. Sobald sich ein Tumor entwickelt hat, können die WissenschaftlerInnen bestimmte Mutationen genau unter die Lupe nehmen, um festzustellen, ob der jeweilige Gendefekt auch für das langfristige Überleben des Tumors essentiell ist. Denn jede genetische Veränderung, die dazu führt, dass der Tumor schrumpft oder verschwindet, könnte ein guter Kandidat für zukünftige Therapien sein.
Organoide für eine personalisierte Krebsmedizin
Die WissenschaftlerInnen testeten dieses Prinzip mit einem Medikament namens Afatinib, das derzeit in klinischen Studien zur Behandlung von Glioblastomen eingesetzt wird. Sie fanden heraus, dass nach 40 Tagen Verabreichung des Medikaments die Anzahl der Tumorzellen in jenen zwei Mutationskombinationen signifikant zurückging, in denen ein Molekül namens EGFR überexprimiert wird- denn Afatinib hemmt EGFR. Die ForscherInnen wiederholten das Experiment mit vier zusätzlichen Wirkstoffen, die EGFR hemmen und derzeit in Therapien zum Einsatz kommen. Während ein Medikament namens Erlotinib die Anzahl der Tumorzellen signifikant reduzierte, waren die Effekte anderer Wirkstoffe minimal.
"Diese Ergebnisse zeigen, dass Gehirn-Organoide auch einen erheblichen Nutzen für die Krebsforschung beziehungsweise die öffentliche Gesundheit haben. Vor allem, weil es nun möglich ist, Organoide von Patienten mit Gehirntumoren herzustellen und daran die Wirksamkeit verschiedener Therapie-Kombinationen zu testen", sagt Jürgen Knoblich. „Nun wäre es ein wichtiger Schritt, weitere klinische Partnerschaften zu fördern. Wir sind davon überzeugt, dass unsere Modelle in Zukunft Anhaltspunkte für die klinische Behandlung von Hirntumoren liefern könnten.“