Wie entsteht Parkinson? Studie weckt Zweifel an bisheriger Theorie
Die Parkinson-Krankheit wurde vor 200 Jahren das erste Mal von einem britischen Arzt beschrieben. Die genauen Ursachen dieser neurodegenerativen Erkrankung sind bis heute nicht geklärt. Ein Forscherteam unter der Leitung von Prof. Henning Stahlberg vom Biozentrum der Universität Basel stellt in einer aktuellen Studie eine bisher gängige Vorstellung in Frage.
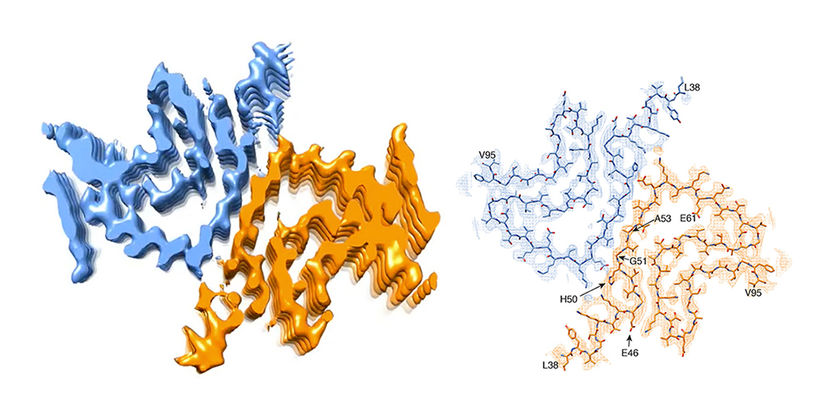
Querschnitt einer alpha-Synuclein-Fibrille. Links: 3-D-Rekonstruktion einer Fibrille, welche zwei miteinander interagierende Proteinmoleküle zeigt. Rechts: Atom-Modell der Fibrillenstruktur.
University of Basel
Die Arme und Beine zittern unaufhörlich, die Muskeln werden zunehmend schwächer und die Bewegungen langsamer – all dies sind typische Symptome, unter denen viele Parkinson-Patienten leiden. Weltweit sind es über sechs Millionen Menschen. Bei den Betroffenen sterben im Gehirn die Dopamin-bildenden Nervenzellen langsam ab. Der daraus resultierende Mangel an diesem Botenstoff beeinträchtigt die Motorik und oft auch die kognitiven Fähigkeiten.
Sind Proteinfibrillen die Verursacher?
Bislang nahm man an, dass einer der Auslöser das Eiweiss alpha-Synuclein sei. Es kann verklumpen und lagert sich als Lewy-Körperchen in den Nervenzellen ab. Die toxischen Proteinfasern richten die Zellen im Gehirn zugrunde. Ein Forscherteam unter der Leitung von Prof. Henning Stahlberg vom Biozentrum der Universität Basel hat in Zusammenarbeit mit Forschern von Hoffmann-La Roche Ltd. und der ETH Zürich so eine alpha-Synuclein-Fibrille nun künstlich im Reagenzgefäss erzeugt und erstmals mit atomarer Auflösung sichtbar machen können. «Entgegen unseren Erwartungen werfen die Ergebnisse allerdings mehr Fragen auf, als sie beantworten», so Stahlberg.
Dazu muss man wissen, dass bei einigen angeborenen Formen von Parkinson die Betroffenen genetische Defekte im alpha-Synuclein-Gen haben. Die Mutationen, so vermutet man, führen schliesslich dazu, dass sich das Protein falsch faltet und sich zu den gefährlichen Fibrillen zusammenlagert. «Unsere 3-D-Struktur zeigt jedoch eine Fibrillen-Struktur, welche mit einem derart mutierten Protein gar nicht gebildet werden könnte», sagt Stahlberg. «Aufgrund ihrer Lage würden die meisten dieser Mutationen die Bildung der von uns gefundenen Fibrillen-Struktur eher behindern.» Kurz gesagt: Wenn diese Fibrillen-Struktur Parkinson auslösen sollte, müsste der Gen-Defekt vor der Krankheit schützen. Dies tut er jedoch nicht. Es könnte sein, dass eine andere Form von Fibrillen oder eine andere Form des Proteins die Krankheit bei diesen Patienten auslöst.
Studie wirft neue Fragen auf
Was die Mutationen im alpha-Synuclein bewirken, ob sich andere Formen von Proteinaggregaten herausbilden, welche Rolle die Fibrillen für die Nervenzellen spielen und woran die Nervenzellen letztlich sterben – diesen Fragen muss nun nachgegangen werden. Bis heute ist die genaue Funktion von alpha-Synuclein nicht klar. Da sich mit den bisherigen Medikamenten nur die Beschwerden lindern lassen, sind dringend neue Konzepte gefragt.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
























































