Tödliches Duo: Wirkmechanismus porenbildender Toxine
Forschungsteam klärt Wirkmechanismus einer Klasse bakterieller Gifte auf
Porenbildende Toxine gehören zu den verbreitetsten bakteriellen Giften. Sie greifen Organismen an, indem sie Löcher in der Zellmembran erzeugen. Ein Wissenschaftsteam der Technischen Universität München (TUM) hat nun den Wirkmechanismus eines dieser Gifte aufgeklärt. Die Erkenntnisse könnten dazu beitragen, entsprechende Krankheiten zu bekämpfen oder Pflanzen vor Schäden zu schützen.
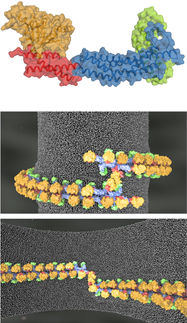
Einzelkomponenten YaxA (blau) und YaxB (lila) sowie eine aus diesen aufgebaute Pore.
Bastian Bräuning / TUM
Porenbildende Toxine sind bakterielle Gifte, die Löcher in der Zellmembran erzeugen und so die Zelle zerstören. Viele bakterielle Krankheitserreger stellen diese her, beispielsweise einige Stämme des Darmbakteriums Escherichia coli sowie das mit dem Pesterreger verwandte Bakterium Yersinia enterolitica. Mit Hilfe ihrer Toxine greifen sie damit sehr unterschiedliche Organismen an – von Pflanzen über Insekten bis hin zum Menschen.
Weltweit versuchen Wissenschaftler zu verstehen, wie genau diese Giftstoffe die fatalen Löcher in der Zellmembran erzeugen, um porenbildende Toxine von Krankheitserregern vielleicht eines Tages hemmen zu können.
Nun ist es einem interdisziplinären Team der TU München gelungen, die Wirkungsweise einer Unterart dieser Toxine aufzuklären, bei der zwei Komponenten zusammenwirken, um die tödliche Wirkung zu entfalten.
Zwei Partner mit tödlicher Wirkung
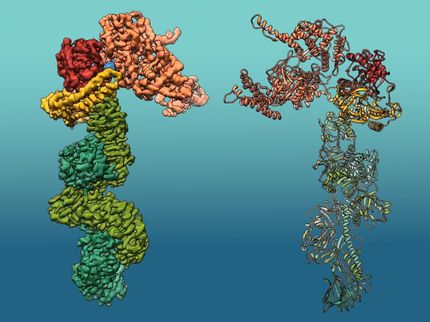
Durch die Kombination kristallografischer und kryo-elektronenmikroskopischer Methoden ist es Bastian Bräuning und Professor Michael Groll vom Lehrstuhl für Biochemie zusammen mit Eva Bertosin und Professor Hendrik Dietz vom Lehrstuhl für experimentelle Biophysik gelungen, die genaue Molekularstruktur sowohl der löslichen Einzelkomponenten, als auch des Porenkomplexes aufzuklären.
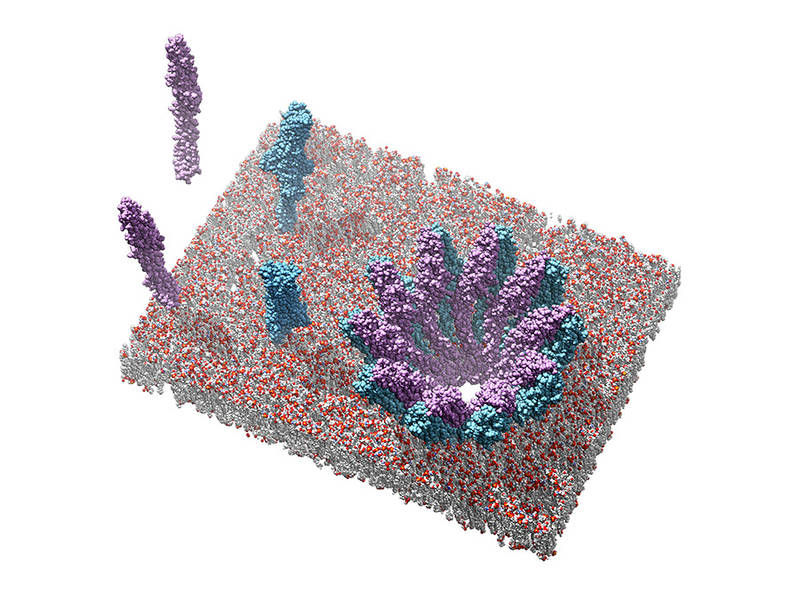
„Wir haben herausgefunden, dass nur die eine der beiden Komponenten an die Membran binden kann. Erst in einem zweiten Schritt rekrutiert sie die zweite Komponente und die Fußdomänen beider Proteine zusammen bilden die Grundeinheit der Pore“, erklärt Bastian Bräuning. „Das ist eine neue Art von Mechanismus, aus dem wir viele nützliche Erkenntnisse gewinnen können.“
Die Struktur des auf diese Weise entstandenen Lochs in der Zellmembran ähnelt dabei einer Krone, deren Zacken aus 40 Untereinheiten der beiden zusammenarbeitenden Partner bestehen.
Ein Mechanismus – viele mögliche Anwendungen
Die Forscher um Bräuning und Groll untersuchten das Zusammenwirken der beiden Partnerproteine an Hand der Gifte von Yersinia enterolitica und Photorhabdus luminescens, einem Bakterium, das in Fadenwürmern lebt und in Symbiose mit diesen Insekten angreift. Letzteres ist daher als Mittel gegen Insekten interessant.
Auch die Entwicklung von Substanzen, die das Zusammenwirken der beiden Komponenten blockieren und damit die Porenbildung verhindern, ist mit Hilfe der neuen Erkenntnisse generell vorstellbar.
„Unsere Kombination aus Kristallographie und Kryo-Elektronenmikroskopie war essentiell um die Notwendigkeit des zweiteiligen Aufbaus dieses Gifttyps biochemisch zu begreifen“, erklärt Professor Michael Groll. „Dieses Wissen hilft uns in Zukunft, noch komplexere Varianten zu verstehen, beispielweise solche, bei denen drei Komponenten zusammenwirken.“
Originalveröffentlichung
Bastian Bräuning, Eva Bertosin, Florian Praetorius, Christian Ihling, Alexandra Schatt, Agnes Adler, Klaus Richter, Andrea Sinz, Hendrik Dietz und Michael Groll; "Structure and mechanism of the two-component alpha-helical pore-forming toxin YaxAB"; Nature Communications; vol. 9, 1806 (2018)