Was krankmachende Bakterien so hartnäckig macht
Wie bindet ein weit verbreiteter Krankheitserreger an sein Zielmolekül?
Bakterien haben ausgeklügelte Strategien entwickelt, um sich in ihren Wirten festzusetzen und zu vermehren. Eine Studie zeigt, welche Rolle dabei auch die Gesetze der Physik spielen. Lukas Milles und Professor Hermann Gaub von der Fakultät der Physik der LMU haben in Zusammenarbeit mit Forschern der University of Illinois in Urbana-Champaign am Beispiel der Staphylokokken untersucht, mit welch außergewöhnlicher mechanischer Beharrlichkeit sich Bakterien mithilfe von Proteinen an den Zielmolekülen ihres Wirtes binden. Dem Team ist es gelungen, den physikalischen Mechanismus zu entschlüsseln, mit dem sich der Erreger an sein Zielmolekül heftet. Zudem stellen sie den Vorgang in bislang unerreichter Detailgenauigkeit dar.
Das Ergebnis ist dem wissenschaftlichen Ansatz der Studie zu verdanken: Die Forscher haben die physikalischen Kräfte zwischen einem Adhäsionsprotein eines Erregers und seinem menschlichen Zielmolekül sowohl am einzelnen Molekül in vitro mittels Raster-Kraft-Mikroskopie gemessen als auch die Wechselwirkung aller beteiligter Atome an einem besonders leistungsstarken Supercomputer berechnet. „Dieser Paradigmenwechsel eröffnet Einblicke, die zuvor gar nicht möglich waren“, sagt Hermann Gaub. So sind am Supercomputer Blue Waters in Illinois, einem der weltweit stärksten Rechner mit 900.000 Prozessoren parallele Molekulardynamik-Simulationen gelaufen, um das komplexe Zusammenspiel zu entschlüsseln. Die Kraft, mit der sich der Erreger an sein Zielmolekül bindet, hat die Forscher überrascht: „Die mechanische Bindungsstärke eines einzelnen Rezeptor-Ligand-Komplexes erreichte eine Kraft von über zwei Nanonewton. Das ist eine außergewöhnliche Stabilität vergleichbar mit der Stärke kovalenter Bindungen zwischen Atomen, den stärksten molekularen Kräften, die wir überhaupt kennen“, sagt Hermann Gaub.
Die Studie zeigt, dass das Adhäsionsprotein des Bakteriums dank seiner Geometrie das Zielmolekül in ein Wasserstoffbrückennetzwerk einbettet, das eher vom Peptidrückgrat als von dessen Seitenketten dominiert wird. Unter der Kraft unzähliger kleiner lokaler Wechselwirkungen versteifen sich diese Bindungen in eine kooperative Schergeometrie, wie das zugrundeliegende physikalische Prinzip heißt. „Diese Geometrie kann extreme Kräfte aushalten, da alle Bindungen parallel gebrochen werden müssten, um das Ziel zu trennen“, sagt Lukas Milles. Eine vereinfachte Analogie sind zwei Klettbandstreifen, die schwierig zu trennen sind, wenn sie von entgegengesetzten Enden gezogen werden. „Das Bakterium nutzt einen ungewöhnlichen Mechanismus, der aber sehr raffiniert ist, und ihm entscheidende Vorteile verschafft“, sagt Gaub:Da der Mechanismus auf das Peptidrückgrat konzentriert ist, die für jedes Protein ähnlich ist, kann die hohe Stabilität für ein breites Spektrum von Zielpeptiden erreicht werden. Dadurch ist die extreme physikalische Stärke des Systems weitgehend unabhängig von der Sequenz und den biochemischen Eigenschaften des Ziels.
Staphylokokken sind für viele Infektionen bei Tieren und Menschen verantwortlich. „Krankmachende Bakterien haften an den Zielmolekülen ihrer Wirten mit außergewöhnlicher mechanischer Beharrlichkeit. Das Verständnis der physikalischen Mechanismen, die dieser hartnäckigen Adhäsion auf molekularer Ebene zugrunde liegen, ist entscheidend für die Bekämpfung solcher Eindringlinge“, sagt Hermann Gaub. Damit legt die Studie Grundlagen für die Entwicklung neuartiger Therapien bei Infektionen mit Staphylokokken.
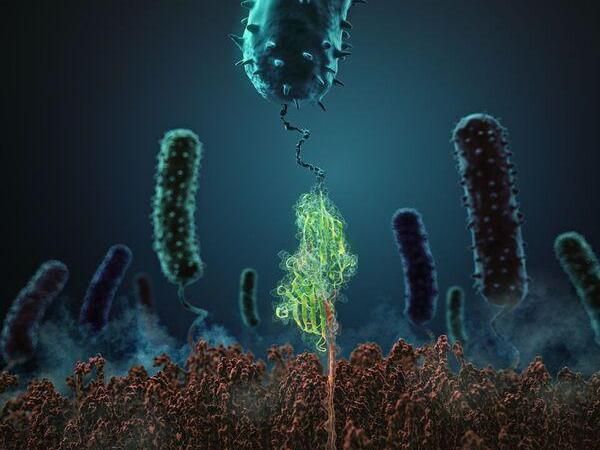
Diese Abbildung zeigt, wie das Staphylokokken-Adhäsionsprotein (in grün) mit seinem verwandten Peptidliganden (rot) interagiert.
H. Gaub, LMU München
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.