Magenbakterium im toten Winkel des Immunsystems
Helicobacter pylori entzieht der Magenschleimhaut Cholesterin und überlebt so Angriffe selbst aus nächster Nähe
Weltweit ist jeder Zweite mit dem Magenbakterium Helicobacter pylori infiziert. Der Erreger kann trotz heftiger Abwehr des Immunsystems jahrzehntelang in der Magenschleimhaut überleben, Magengeschwüre und Krebs können die Folge sein. Wissenschaftler am Max-Planck-Institut für Infektionsbiologie in Berlin haben nun herausgefunden, wie das Bakterium inmitten einer Immunreaktion überleben kann: Es entzieht den Membranen infizierter Zellen das Cholesterin. Dieses Fettmolekül ist u.a. für die Funktion von Interferon-Rezeptoren erforderlich. Durch den Entzug können die Schleimhautzellen wichtige Botenstoffe des Immunsystems nicht mehr wahrnehmen. So schafft sich das Bakterium eine Nische, in der es unbehelligt bleibt.
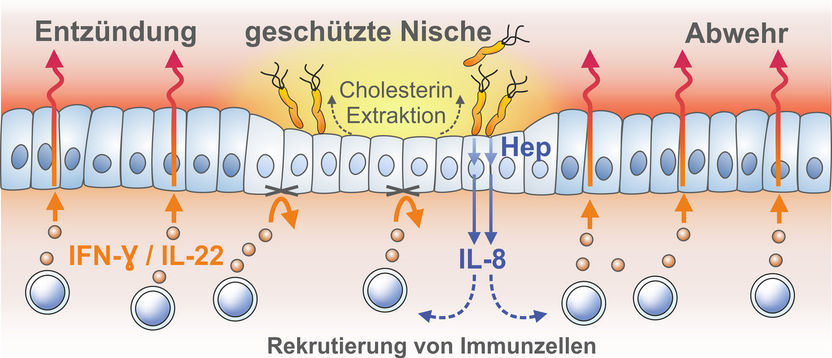
Helicobacter pylori (orange) entzieht Zellen der Magenschleimhaut Cholesterin. Dadurch können die Zellen nicht mehr auf einen Signalstoff des Immunsystems reagieren, und das Bakterium bleibt unentdeckt.
© MPI f. Infection Biology
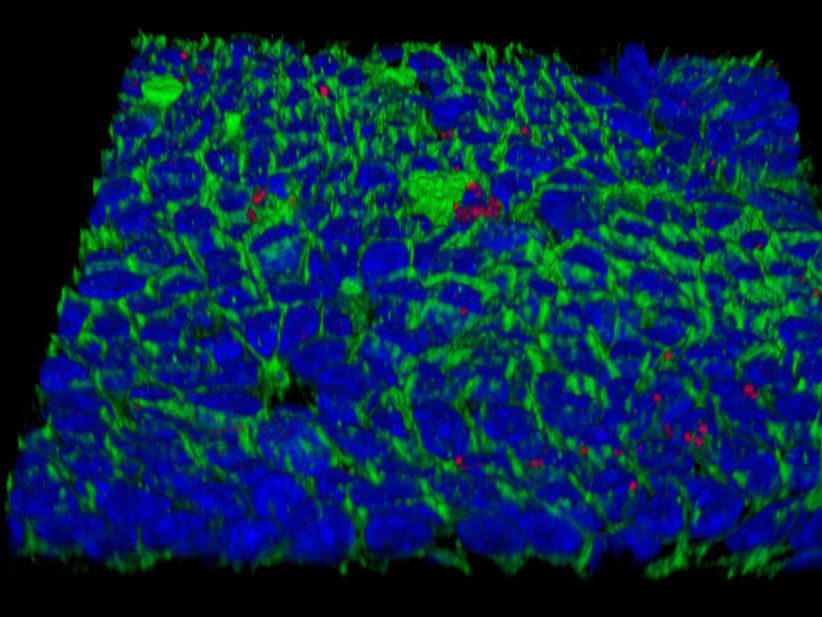
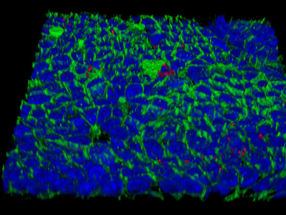
Oberfläche eines mit Helicobacter infizierten sogenannten Mukosoids aus menschlichen Magenschleimhautzellen (rot: Helicobacter pylori, blau: Zellkerne, grünn: Zellmembrane).
© MPI f. Infection Biology
Hielt man Stress und ungesunde Ernährung lange Zeit für die Hauptursachen von Entzündungen der Magenschleimhaut (Gastritis) und Geschwüren, so ist seit den 1980er Jahren das Bakterium Helicobacter pylori als der eigentliche Übeltäter bekannt. Der Erreger gilt zudem als größter Risikofaktor für Magenkrebs.
Die Forscher um Thomas F. Meyer, Direktor am Max-Planck-Institut für Infektionsbiologie, liefern erstmals eine Erklärung dafür, warum bislang Versuche gescheitert sind, einen Impfstoff gegen H. pylori zu entwickeln: Der Erreger blockiert die Wirkung von den zu Hilfe gerufenen Immunzellen und deren Botenstoffen. Einer früheren Studie der Berliner Wissenschaftler zufolge bildet der Erreger ein Enzym, mit dem er Wirtszellen Cholesterin entziehen kann. Fehlt den Erregern dieses Enzym, können sie Mäuse nicht mehr infizieren. Erhielten Mäuse eine besonders Cholesterin-reiche Nahrung, konnten sie die Erreger für den Preis einer noch stärkeren Entzündung partiell abwehren. Wie genau aber der Erreger das Fettmolekül einsetzt, um die Immunabwehr auszutricksen, blieb damals offen.
Magenschleimhaut in der Petrischale
Eine neue Methode hat nun zur Lösung des Rätsels beigetragen; denn den Forschern ist es gelungen, eine Magenschleimhaut im Labor zu züchten. Diese – auch Mukosoide genannten – Mini-Organe bestehen aus einer Schicht Epithelzellen mit einer Außen- und Innenseite. Die Mini-Organe produzieren sogar die für die Magenschleimhaut typische Schleimschicht und können selbst nach Infektion mit H. pylori über Monate hinweg am Leben erhalten werden.
Normalerweise rufen die Zellen der Magenschleimhaut als Reaktion auf eine Infektion mit H. pylori Immunzellen zu Hilfe und bilden Abwehrstoffe gegen den Erreger. Eine zentrale Rolle spielt dabei ein Signalstoff des Immunsystems, das von den Epithelzellen gebildet wird: das sogenannte Interferon-γ.
Ohne Cholesterin keine Lipid-Flöße
Dank der Mukosoide haben die Wissenschaftler herausgefunden, dass H. pylori dauerhaft kleine Kolonien auf den Mini-Organen bildet. Indem der Erreger den benachbarten Zellen Cholesterin entzieht, können in deren Zellmembran keine aus Cholesterin bestehenden „Lipidflöße“ mehr gebildet werden, die für den korrekten Zusammenhalt der Rezeptormoleküle für Interferon-γ entscheidend sind. Zellen in dieser Nische können damit nicht mehr auf diesen Signalstoff reagieren.
„Wir können nun viele, lange unbeantwortet gebliebene Fragen beantworten und sehen die Infektion in einem völlig anderen Licht“, sagt Pau Morey, der Erstautor der Studie. „Dank der Mukosoide können wir Entzündungsprozesse über einen langen Zeitraum hinweg untersuchen und wichtige Erkenntnisse über die Abwehrreaktionen der Schleimhaut sowie die Entstehung von Krebs gewinnen“, erklärt Francesco Boccellato, der die Technik entwickelt hat.
Originalveröffentlichung
Morey P, Pfannkuch L, Pang E, Boccellato F, Sigal M, Imai-Matsushima A, Dyer V, Koch M, Mollenkopf H-J, Schlaermann P, Meyer TF; "Helicobacter pylori Depletes Cholesterol in Gastric Glands to Prevent Interferon gamma Signaling and Escape the Inflammatory Response"; Gastroenterology; Published online: December 19, 2017.
Boccellato F, Woelffling S, Imai-Matsushima A, Sanchez A, Goosmann C, Schmid M, Berger H, Morey P, Denecke C, Ordemann J, Meyer TF; "Polarised epithelial monolayers of the gastric mucosa reveal insights into mucosal homeostasis and defence against infection"; Gut; Published online 21 February 2018.