Neuer Hemmstoff gegen hartnäckige bakterielle Biofilme
Neues kleines Molekül unterdrückt Bildung gefährlicher Biofilme und lässt sich oral verabreichen
Bakterien der Art Pseudomonas aeruginosa weisen häufig Resistenzen gegen gängige Antibiotika auf und zählen zu den Krankenhauskeimen. Sie können alle Organe des Menschen sowie Implantate befallen und in einer dicht zusammengelagerten Gemeinschaft – einem sogenannten Biofilm – lange Zeit im Körper überdauern. Dabei schützt sie der Zusammenhalt im Biofilm vor dem Immunsystem und schirmt sie sogar gegen Antibiotika ab. Am Helmholtz-Institut für Pharmazeutische Forschung Saarland (HIPS) ist es Wissenschaftlern mit einem selbst entwickelten Molekül gelungen, die Biofilmbildung bei Pseudomonas zu unterdrücken. Das Molekül hat einen weiteren entscheidenden Vorteil: Durch seine geringe Größe eignet es sich zur oralen Einnahme, was bei entsprechenden Wirkstoffen bisher nicht möglich war.
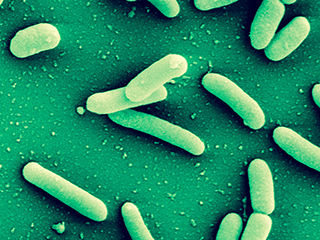
Bakterien der Art Pseudomonas aeruginosa sind äußerst widerstandfähig und kommen fast überall vor.
© HZI/Manfred Rohde
Besonders für Krankenhauspatienten mit geschwächtem Immunsystem ist der Erreger Pseudomonas aeruginosa eine ernst zu nehmende Gefahr. Bakterien dieser Art können alle Organe des Körpers infizieren und so zum Beispiel wiederkehrende Lungenentzündungen, Sepsis oder chronische Wundinfektionen verursachen. Durch ihre vielfältigen Resistenzen gegen Antibiotika sind die Bakterien oft nur schwer behandelbar. Dazu kommt, dass Pseudomonaden in der Lage sind, sich einen eigenen, schützenden Lebensraum zu schaffen: Sie lagern sich zu dichten Kolonien – sogenannten Biofilmen – zusammen, die sie gegen Abwehrreaktionen des Immunsystems und gegen Antibiotika abschirmen. Daher suchen Wissenschaftler nach möglichen Angriffszielen in den Prozessen der Biofilmbildung, um Pseudomonaden zu bekämpfen.
Eine Schlüsselrolle bei der Ausbildung von Biofilmen spielen Lektine. Diese Proteine werden von den Bakterien freigesetzt und binden außerhalb der Bakterienzellen an Zuckermoleküle. So vernetzen sie die Zuckermoleküle zu einer Matrix und helfen den Pseudomonaden, sich am Gewebe des infizierten Wirtes anzuheften und dort eine dichte Kolonie auszubilden. „Wenn es gelingt, die Zuckerbindestelle der Lektine zu blockieren, kann Pseudomonas keinen Biofilm mehr bilden und wird für Medikamente empfänglich“, sagt Dr. Alexander Titz, der in Saarbrücken die Nachwuchsgruppe „Medizinische Chemie von Naturstoffen“ des Deutschen Zentrums für Infektionsforschung leitet. Ausgehend vom Zuckermolekül Mannose, das eines der natürlichen Bindungspartner des Lektins LecB ist, haben die Wissenschaftler um Titz über fünf Jahre hinweg ein künstliches Molekül entwickelt, das hochspezifisch an LecB bindet und das Protein so blockiert.
„Wir haben uns die dreidimensionale Molekülstruktur des Komplexes von LecB mit Mannose angeschaut und darauf basierend ein kleines Molekül entworfen, das ähnliche Bindeeigenschaften aufweisen sollte“, sagt Titz. „Die Struktur dieses Moleküls haben wir Schritt für Schritt anhand von Laborergebnissen optimiert, sodass es nun ausreichend lange an LecB binden kann und auch gegenüber abbauenden Enzymen des Körpers stabil ist.“ Der entscheidende Vorteil des neuen Moleküls ist seine geringe Größe: „Bisher waren Lektinhemmstoffe große Moleküle mit sehr hohem Gewicht, die entgegen der erwünschten Wirkung die Biofilme sogar teilweise stabilisiert haben, weil sie die Funktion der Zuckermoleküle übernommen haben“, sagt Titz. „Wir haben dagegen in Zellkulturexperimenten eindeutig nachgewiesen, dass kleine Moleküle dies nicht können. Sie hindern die Pseudomonaden tatsächlich daran, einen Biofilm zu bilden.“
Zudem haben die Wissenschaftler vergleichende Versuche zur Darreichungsform des neuen Moleküls an Mäusen durchgeführt. Dazu haben sie den Wirkstoff einer Gruppe von Mäusen intravenös und einer anderen oral verabreicht. Untersuchungen des Blutes und des Urins nach 24 Stunden haben gezeigt, dass der Wirkstoff auch bei oraler Gabe erfolgreich aufgenommen und im Körper verteilt wurde. „Das ist ein wesentlicher Vorteil kleiner Moleküle, denn bisher waren Lektinhemmstoffe zu groß, um oral eingenommen zu werden – diese müssten immer injiziert werden“, sagt Alexander Titz. Die Entwicklung des neuen LecB-Hemmstoffs erfolgte in enger Kooperation mit den Abteilungen „Chemische Biologie“ (HZI) und „Wirkstoffdesign und Optimierung“ (HIPS). Eine direkte klinische Anwendung ist allerdings noch nicht in Sicht, dazu sind zunächst zahlreiche weitere Studien notwendig.
Am 13. März wird Alexander Titz von der Gesellschaft Deutscher Chemiker (GDCh) mit dem Innovationspreis in Medizinisch/Pharmazeutischer Chemie 2018 ausgezeichnet. Der Preis wird bereits seit 1999 verliehen und würdigt herausragende wissenschaftliche Publikationen und Ergebnisse in der medizinisch-pharmazeutischen Chemie. Er ist mit 5000 Euro dotiert und wird in diesem Jahr geteilt.
Originalveröffentlichung
Roman Sommer, Stefanie Wagner, Katharina Rox, Annabelle Varrot, Dirk Hauck, Eike-Christian Wamhoff, Janine Schreiber, Thomas Ryckmans, Thomas Brunner, Christoph Rademacher, Rolf W. Hartmann, Mark Brönstrup, Anne Imberty, and Alexander Titz; "Glycomimetic, Orally Bioavailable LecB Inhibitors Block Biofilm Formation of Pseudomonas aeruginosa"; J. Am. Chem. Soc.; 2018