Wenn Eiweiße einander die Hand geben
Materialwissenschaftler erzeugen innovatives Nanomaterial aus Naturstoffen
Ob in Spinnenseide, Holz, dem Raum zwischen Körperzellen, in Sehnen oder als natürliche Abdeckung kleiner Wunden: Fasern aus Eiweißen finden sich in der Natur sehr häufig. Die kleinen Eiweißfasern, von Experten auch Proteinnanofasern genannt, weisen häufig hervorragende Eigenschaften, wie hohe Festigkeit, Bioabbaubarkeit oder antibakterielle Wirkung auf. Der Nachbau solcher Proteinfasern ist nicht einfach, geschweige denn, diesen Fasern spezifische Funktionen zuzuordnen. Dass und wie es gelungen ist, Fasern mit neuen Eigenschaften zu erzeugen, beschreiben Materialwissenschaftler der Friedrich-Schiller-Universität Jena in der aktuellen Ausgabe der Fachzeitschrift „ACS NANO“. Unterstützt wurden sie dabei von einem Team vom Leibniz-Institut für Photonische Technologien Jena (Leibniz-IPHT).
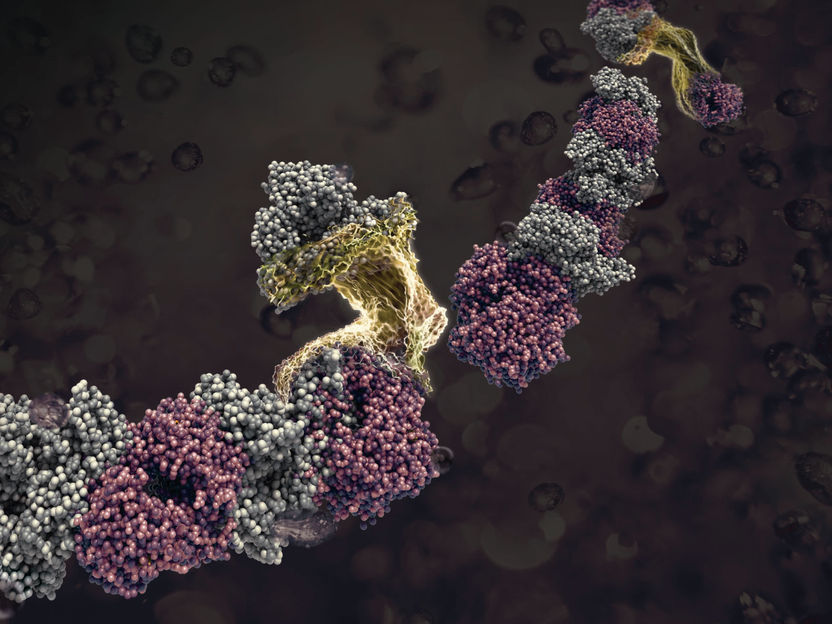
Hybrid-Proteinnanofasern bei der Entstehung.
Dr. Izabela Firkowska-Boden/FSU Jena
„Proteinfasern bestehen aus mehreren natürlichen Eiweiß-Makromolekülen“, erklärt Prof. Dr. Klaus D. Jandt vom Otto-Schott-Institut für Materialforschung der Uni Jena und fährt fort: „Die Natur baut diese Nanomaterialien, die einen Durchmesser von etwa einem Tausendstel eines menschlichen Haares aufweisen, durch Selbstorganisationsprozesse.“ Was für die Natur mit ihrer Jahrmillionen langen Erfahrung kein Problem ist, lässt sich aber meist nicht so einfach vom Menschen nachbauen. Dennoch gelang es Prof. Jandt und seiner Gruppe in den vergangenen Jahren, Proteinnanofasern aus den natürlichen Proteinen Fibrinogen und Fibronektin zu erzeugen und die Größe und die Struktur dieser Fasern – linear oder verzweigt – zu steuern.
Proteinnanofasern mit definierten Eigenschaften
Als nächstes hatten die Forscher um Prof. Jandt sich das Ziel gesetzt, bestimmte Eigenschaften der Proteinnanofasern vorzugeben, um diese später als Bausteine in Biosensoren, Wirkstofftransportpartikeln, optischen Sonden oder Knochenzementen einzusetzen. Dabei hatten die Jenaer Materialforscher die Idee, zwei verschiedene Eiweiße in einer sich selbst zusammenbauenden Proteinnanofaser zu kombinieren, um so neue Fasereigenschaften zu erzeugen. Jandt und sein Team hatten Erfolg: Sie nutzten dazu das Protein Albumin, das für den osmotischen Druck im Blut verantwortlich ist, und Hämoglobin, das Eiweiß des roten Blutfarbstoffs, das zum Sauerstofftransport im Blut dient. Beide Proteine wurden von den Forschern in Ethanol gelöst und anschließend auf 65 °C erwärmt. Dabei bildeten sich – über mehrere Zwischenstufen – scheinbar selbstständig erstmals neue Hybrid-Proteinnanofasern, die beide Eiweiße enthielten. Dabei geben die beiden Proteine sich quasi die Hand, das heißt, es verbinden sich ähnliche Abschnitte der beiden Proteine zu einer Faser.
„Der Nachweis, dass diese neuen Hybrid-Proteinnanofasern wirklich beide Proteine enthalten, war nicht einfach, da diese Fasern so winzig sind und es kaum Mikroskopiemethoden gibt, die Details in den Fasern sehen können“, erklärt Klaus Jandt und ergänzt: „Bei diesem Nachweis haben uns Prof. Deckert und sein Team vom Leibniz-Institut für Photonische Technologien entscheidend unterstützt.“ Prof. Dr. Volker Deckert und seine Mitarbeiter fanden in den neuen Hybrid-Proteinnanofasern optische Signale, die sowohl für Albumin, als auch für das Hämoglobin typisch sind wie der Fingerabdruck für einen Menschen. Sie setzten dafür die sogenannte Tip-enhanced Raman Spectroscopy (TERS) ein. „Durch die extreme Empfindlichkeit des Verfahrens konnten wir die unterschiedlichen Proteine sogar ohne spezielle Markierungen unterscheiden und in enger Kooperation mit den Kollegen von Prof. Jandt auch eindeutig zuordnen“, sagt Prof. Deckert vom Leibniz-IPHT in Jena.
Biomimetische Prinzipien für die Werkstoffe der Zukunft
In der Erzeugung und dem Nachweis der neuen Nanofasern, die aus mehreren Eiweißen bestehen, sehen die Jenaer Forscher einen Durchbruch. Mit den innovativen Fasern können jetzt ganz neue, größere Strukturen mit gewünschten Eigenschaften gezielt aufgebaut werden, die vorher nicht möglich waren. Netzwerke aus den neuen Nanofasern sollen in Zukunft z. B. als neues Material zur Regeneration von Knochen und Knorpel genutzt werden. „Dadurch ist das Tor aufgestoßen für eine ganz neue Generation von funktionellen Materialien für die Medizintechnik, die Nanoelektronik, Sensorik oder die Optik, die auf natürlichen Stoffen und Bauprinzipien basieren", ist sich Prof. Jandt sicher und ergänzt: „Diese biomimetischen Prinzipien werden die Werkstoffe der Zukunft entscheidend bestimmen.“ Die Jenaer Forscher sind zuversichtlich, dass dieser neue Selbstorganisationsansatz erfolgreich auf andere Proteine übertragen werden kann, wenn diese in Teilen die gleichen Aminosäuresequenzen aufweisen.

























































