Gen-Taxi mit Turboantrieb
DNA-Transfer bei Gentherapien verbessert
Parkinson, Chorea Huntington, Mukoviszidose – diese und viele andere meist tödlich verlaufende Erbkrankheiten des Menschen sind genetisch bedingt. Auch viele Krebsarten und Herzkreislauferkrankungen sind auf Fehler im Erbgut zurückzuführen. Eine vielversprechende Möglichkeit zur Behandlung dieser Krankheiten ist die Gentherapie. Mit Hilfe von gentechnisch modifizierten Viren wird DNA in Zellen eingeschleust, um defekte Gene zu reparieren oder zu ersetzen. Wissenschaftler am Deutschen Primatenzentrum (DPZ) – Leibniz-Institut für Primatenforschung haben herausgefunden, wie erkrankte Zellen mit dieser Methode zukünftig noch schneller und effizienter behandelt werden können. Dafür veränderten die Forscher sogenannte HEK293-Zelllinien, die für die Produktion therapeutischer Viren genutzt werden. Die Zellen produzierten daraufhin ein Protein, genannt CD9, in großer Menge. Außerdem veränderten sie die für den Gentransfer genutzten Viren so, dass CD9 in deren Hüllmembran integriert wird. Diese genetischen Manipulationen führten dazu, dass die Viren die Zielzellen schneller und effizienter infizierten. Die dadurch erreichte höhere Übertragungsrate der DNA in die Zielzellen verspricht zukünftig neue und verbesserte Behandlungsmöglichkeiten innerhalb der Gentherapie.
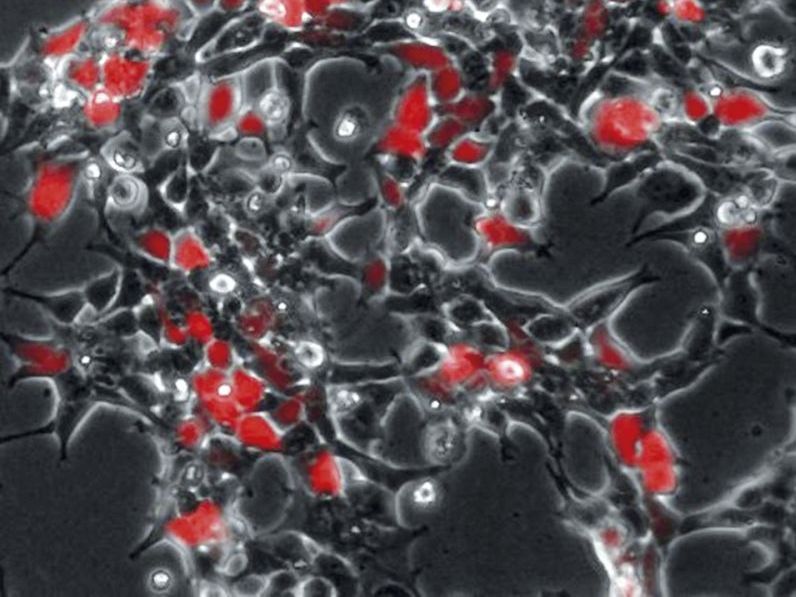
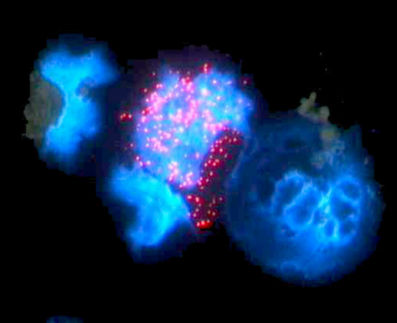
Menschliche HEK293-Zellen produzieren nach der Infektion mit CD9-haltigen Viren ein rot fluoreszierendes Reporterprotein (RFP), das die erfolgreiche Übertragung viraler Erbinformation in die Zellen anzeigt.
Kai Böker
Die Fähigkeit von Viren, ihr Erbmaterial in Wirtszellen einzuschleusen, wird als Werkzeug in der Gentherapie eingesetzt. Diese „Gen-Taxis“ bestehen aus veränderten Viren, den sogenannten viralen Vektoren. Sie werden mit funktionsfähigen Genen bestückt, welche die defekten, krankmachenden Gene in den Zellen ersetzen sollen. Voraussetzung ist aber, dass die Viren die entsprechenden Zellen zuverlässig erkennen und infizieren. Hier setzt die Forschung der Nachwuchsgruppe Medizinische RNA-Biologie am Deutschen Primatenzentrum an.
Transportbläschen in der Zelle sollen Effizienz der Gentherapie erhöhen
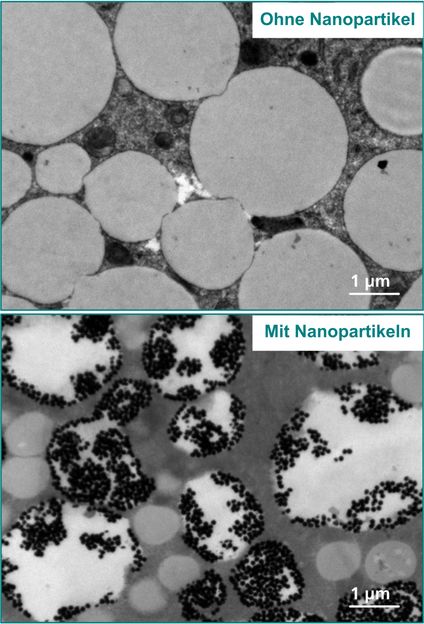
„In unserer Studie wollten wir herausfinden, ob und wie man die Infektionsrate von viralen Vektoren verbessern kann“, sagt Jens Gruber, Leiter der Nachwuchsgruppe und Senior-Autor der Studie. „Im Moment liegen die Infektionsraten, abhängig von den Zielzellen, oft bei rund 20 Prozent. Das ist für bestimmte Therapien zu wenig.“ Um das zu ändern, haben sich die Forscher die Produktion von sogenannten Exosomen angeschaut und überlegt, wie sie diesen Mechanismus nutzen können, um die Virenvektoren effizienter zu machen. Exosomen sind kleine Membranbläschen gefüllt mit Proteinen, RNA oder anderen Molekülen. Sie dienen zum Transport von Zellbestandteilen und zur Kommunikation zwischen Zellen. „Unsere Hypothese war, dass wir die Erzeugung von Viren und ihre Effizienz verbessern können, wenn wir die Exosomenproduktion in den Zellen ankurbeln“, erklärt Jens Gruber die Relevanz der Transportbläschen für die Studie.
Um das zu erreichen, veränderten Jens Gruber und sein Team die HEK293-Zelllinien, die zur Produktion viraler Vektoren genutzt werden, genetisch so, dass sie das CD9-Protein in großer Menge herstellten. Dieses Protein ist bekannt für seine Funktion in der Zellbewegung, beim Zell-Zell-Kontakt und bei der Membranfusion. Die Vermutung war, dass es auch bei der Exosomenproduktion eine Rolle spielen könnte. Darüber hinaus bauten die Wissenschaftler das CD9-Protein in die Hüllmembran von Virenvektoren ein. „Wir konnten zwei Dinge beobachten“, fasst Jens Gruber die Ergebnisse zusammen. „Erstens war die Exosomenproduktion in den HEK293-CD9-Zellen gegenüber den unbehandelten HEK293-Zellen stark erhöht, was für eine entscheidende Rolle des Proteins bei der Exosomenentstehung spricht. Zweitens wurde durch den Einbau des CD9-Proteins in der Virenmembran die Effizienz der DNA-Übertragung aus den Viren erheblich verbessert. Das zeigte sich in einer erhöhten Anzahl an infizierten Zielzellen, die das gewünschte Gen trugen, ohne dass mehr Virenvektoren dafür eingesetzt wurden.“
80-prozentige Infektionsrate
Die erhöhte CD9-Menge in den Viren führte zu einer gesteigerten, rund 80-prozentigen Infektionsrate. Das Protein scheint also eine direkte Auswirkung auf die Exosomenproduktion und Vireneffizienz zu haben, die bisher noch nicht beschrieben wurde. „Die Ergebnisse unserer Studie tragen dazu bei, die Entstehung von Exosomen und zugleich die Virusproduktion in Zellen zu verstehen“, sagt Jens Gruber. „Diese Erkenntnisse können genutzt werden, um momentan verwendete Viren-basierte Gentherapien effizienter zu machen. Zukünftig könnte man eventuell ganz auf Viren verzichten und Erbmaterial nur über Exosomen in Zielzellen schleusen.“
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Gentherapie
Genetische Erkrankungen, die einst als unbehandelbar galten, stehen nun im Zentrum innovativer therapeutischer Ansätze. Die Forschung und Entwicklung von Gentherapien in Biotech und Pharma zielen darauf ab, defekte oder fehlende Gene direkt zu korrigieren oder zu ersetzen, um Krankheiten auf molekularer Ebene zu bekämpfen. Dieser revolutionäre Ansatz verspricht nicht nur die Behandlung von Symptomen, sondern die Beseitigung der Krankheitsursache selbst.

Themenwelt Gentherapie
Genetische Erkrankungen, die einst als unbehandelbar galten, stehen nun im Zentrum innovativer therapeutischer Ansätze. Die Forschung und Entwicklung von Gentherapien in Biotech und Pharma zielen darauf ab, defekte oder fehlende Gene direkt zu korrigieren oder zu ersetzen, um Krankheiten auf molekularer Ebene zu bekämpfen. Dieser revolutionäre Ansatz verspricht nicht nur die Behandlung von Symptomen, sondern die Beseitigung der Krankheitsursache selbst.