Molekulare Wechselwirkungen messen
Unbekannte Wechselwirkungen zwischen Proteinen und kleinen Stoffwechselmolekülen entdeckt
ETH-Forschende entdecken mit einem neuen Ansatz in Bakterienzellen bisher unbekannte Wechselwirkungen zwischen Proteinen und kleinen Stoffwechselmolekülen. Die Technik lässt sich auch dazu verwenden, um die Wirkung von Medikamenten zu testen.
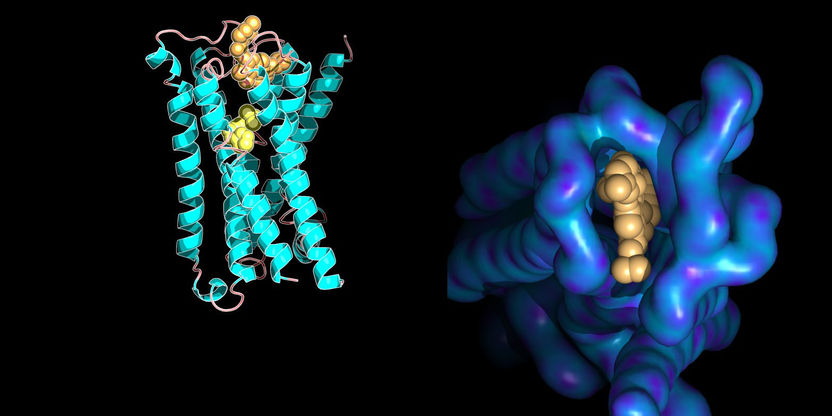
Wechselwirkungen sichtbar gemacht: Molekülmodell eines Membranrezeptors mit an ihn gebundenen kleinen Molekülen. Die rechte Abbildung zeigt Strukturdetails einer bestimmten Bindungsstelle.
Ilaria Piazza / ETH Zürich / PDB database entry 4MQT
Die Wissenschaft hat schon einige «Omiken» gesehen, wie etwa die Genomik oder die Proteomik. Erstere befasst sich mit der systematischen Analyse aller Gene eines Organismus, letztere mit der Gesamtheit aller Proteine in einer biologischen Einheit.
Mit der Protein-Metabolit-Interaktomik fügt nun die Gruppe von Paola Picotti, Professorin für molekulare Systembiologie, den «Omiken» eine weitere hinzu. Die Gruppe hat eine Studie veröffentlicht, in der sie erstmals Wechselwirkungen von allen Proteinen mit kleinen Stoffwechselmolekülen, den Metaboliten, systematisch auf Stufe des gesamten Proteoms analysiert, quantifiziert und in Bezug zueinander setzt.
Schnittstellen machen den Unterschied
Die Forschenden haben aufgezeigt, wie viele aller der in einer E.-coli-Bakterienzelle vorliegenden Proteine und Enzyme mit Metaboliten interagieren. Die Wissenschaftler nutzten dazu einen Ansatz, den sie Limitierte Proteolyse (LiP) nennen, gekoppelt mit massenspektrometrischen Messungen.
Dazu extrahierten die Forschenden aus der Bakterienzelle den Zellsaft mit sämtlichen darin vorkommenden Proteinen. Einer solchen Probe fügten sie jeweils einen Metaboliten zu und liessen ihn mit den Proteinen interagieren. Schliesslich liessen sie die Proteine von «molekularen Scheren» in kleinere Schnipsel (Peptide) zerstückeln. Insgesamt testeten die Forschenden auf diese Weise 20 verschiedene Metaboliten und ihre Wechselwirkung mit Proteinen.
Wenn ein Protein mit einem Metabolit interagiert, sei es, indem dieser in dessen aktives Zentrum zu liegen kommt oder an anderer Stelle andockt, verändert sich die Proteinstruktur. Die «molekulare Schere» zerschneidet diese an anderen Stellen als die Ursprungsstruktur, was einen unterschiedlichen Satz an Peptiden ergibt.
Mit dem Massenspektrometer massen die Forschenden alle in der Probe vorliegenden Schnipsel und rekonstruierten am Computer anhand der erhaltenen Daten die Strukturunterschiede oder -veränderungen und wo diese im Protein lokalisiert sind.
Die Kenntnisse über das Protein-Metabolit-Interaktom, also die Interaktionen zwischen Proteinen und Metaboliten sowie die dazu gehörenden molekularen (Signal-)Netzwerke, waren bisher sehr bescheiden, verglichen mit demjenigen über Wechselwirkungen zwischen Proteinen untereinander oder Proteinen und DNA oder RNA. Diese Studie vergrössert dieses Wissen nun schlagartig.
Hunderte neuer Wechselwirkungen entdeckt
Für E. coli entdeckten Picotti und ihr Team mit diesem Ansatz rund 1650 verschiedene Protein-Metabolit-Wechselwirkungen, davon waren über 1400 bislang unbekannt. Zum Vorschein kamen zudem tausende Bindungsstellen auf Proteinen, an denen Metaboliten andocken können. «Obwohl der Stoffwechsel von E. coli und viele daran beteiligte Moleküle schon sehr gut bekannt sind, gelang es uns, viele neue Interaktionen und entsprechende Bindungsstellen zu entdecken», freut sich die Forscherin. Dies belege das hohe Potenzial des gewählten Ansatzes. «Daten, die wir mit dieser Technik erzeugten, helfen, neue regulatorische Mechanismen, unbekannte Enzyme und neuartige Stoffwechselreaktionen in der Zelle zu identifizieren.»
In ihrer Studie zeigen die Forschenden weiter auf, dass kleine Stoffwechselmoleküle bevorzugt an diejenigen Proteine binden (und sie dadurch regulieren), deren Konzentration über die Zeit mehr oder weniger konstant ist. Dies lässt vermuten, dass das Binden von Metaboliten an Proteine sowie Änderungen von Protein-Konzentrationen zwei sich ergänzende Wege sind, wie Zellen die Proteinaktivität regulieren.
Strukturveränderung reguliert Aktivität
Proteine können über eine durch Metaboliten vermittelte Strukturänderung relativ schnell aktiviert oder inaktiviert werden. «Eine solche Strukturänderung lässt sich rascher wieder rückgängig machen», erklärt Picotti. Aus Sicht der Zelle ist das oft sinnvoll. Denn der Weg über eine Konzentrationsänderung bedeutet für die Zelle, dass sie Proteine ab- oder neu aufbauen muss. Das kostet sie mehr Zeit, Energie und Ressourcen.
Picotti und ihre Mitarbeiterinnen haben zudem aufzeigen können, dass etliche Enzyme weniger wählerisch sind als bisher gedacht. Sie können offenbar mehrere verschiedene Metaboliten binden und chemisch umbauen. Bisher ging man davon aus, dass Enzyme mehrheitlich spezifisch sind für wenige, sehr ähnliche Moleküle.
Wirkstoffe mit neuem Ansatz testen
Am neuen Ansatz ist die Pharmaindustrie stark interessiert. Mit der Methode kann man die Wechselwirkung von Wirkstoffen mit zellulären Proteinen testen und die Ziele eines Medikaments zu identifizieren. So könnten Forschende untersuchen, an welche Proteine und an welche Stellen dieser Wirkstoff bindet, wie er dessen Struktur verändert und damit dessen Aktivität beeinflusst. Dies erleichtert und beschleunigt Tests und die Entwicklung neuer Wirkstoffe.
Die ETH-Professorin hat die Methode bereits patentieren lassen. Exklusiver Lizenznehmer ist das ETH-Spin-off Biognosys, das nun damit im Auftrag von Pharmafirmen verschiedene Wirkstoffe auf diese Weise prüft.