Mechanismus zum Einbau von Eiweißmolekülen in Hülle der Mitochondrien aufgeklärt
Forschern der Universität Freiburg ist es gelungen zu beschreiben, wie die so genannten Beta-Barrel-Proteine in die Membran von Mitochondrien eingebaut werden. Diese Proteine ermöglichen es den Zellkraftwerken, Moleküle zu importieren und zu exportieren. Damit hat das Team um Prof. Dr. Nils Wiedemann und Prof. Dr. Nikolaus Pfanner in Zusammenarbeit mit der Arbeitsgruppe von Prof. Dr. Carola Hunte eine grundlegende Frage der Proteinbiochemie geklärt. Der Europäische Forschungsrat (ERC) hat die Forschung mit einem Consolidator Grant gefördert.
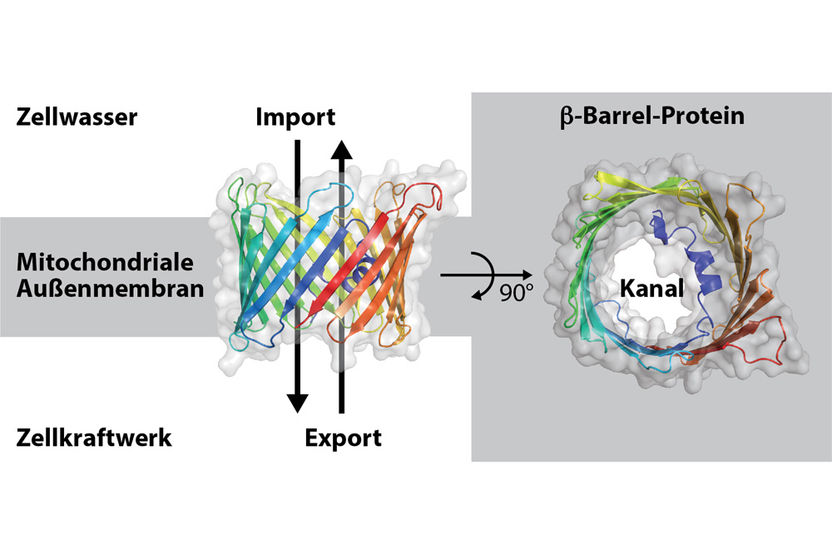
Modell des Beta-Barrel-Proteins Porin aus Bäckerhefe.
Christophe Wirth
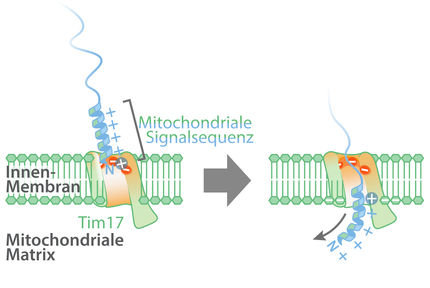
Die Mitochondrien, auch bekannt als Zellkraftwerke, bestehen aus etwa 1.000 Eiweißmolekülen, die aus dem Zellwasser eingeschleust werden. Für diesen Zweck hat ihre äußere Membran Proteinimportkanäle aus Eiweißmolekülen mit einer Fassstruktur, den Beta-Barrel-Proteinen. In den Mitochondrien wird mit Hilfe der Energie aus der Nahrung das zelluläre Energiemolekül Adenosintriphosphat (ATP) hergestellt. Über weitere Fassprotein-Poren wird ATP über die mitochondriale Außenmembran in das Zellwasser geschleust. So wird das Leben menschlicher Zellen angetrieben.
Vor knapp 30 Jahren klärte die Arbeitsgruppe von Prof. Dr. Georg Schulz an der Universität Freiburg die Struktur der Beta-Barrel-Membranproteine auf: In entgegengesetzte Richtungen verlaufende Stränge der Proteine bilden Faltblätter, die durch Zusammenlagerung des ersten und des letzten Stranges einen hohlen Zylinder formen. Seitdem stellte sich die Frage, wie diese Klasse von kanalbildenden Eiweißmolekülen in biologische Membranen eingebaut wird. Daraufhin wurde in der Außenmembran der Mitochondrien eine Sortierungs- und Assemblierungs-Maschinerie (SAM) identifiziert, die den Einbau der Fassproteine ermöglicht. Die zentrale Untereinheit von SAM für die Bildung der Beta-Barrel-Proteine heißt Sam50. Hier setzt die aktuelle Arbeit an: Dr. Alexandra Höhr wies experimentell nach, dass der letzte Strang des neuen Proteins zwischen den ersten und den letzten Strang des Sam50-Beta-Barrels eingesetzt wird, womit der Membraneinbau startet. Zusammen mit Caroline Lindau zeigte sie, dass Stück für Stück weitere Stränge des neuen Beta-Barrels in die seitliche Öffnung von Sam50 eingefädelt werden, bis der neue vollständige Kanal in die Membran entlassen wird.
Weil Mitochondrien und die photosynthetischen Chloroplasten von gemeinsamen bakteriellen Vorfahren abstammen, trägt die Studie nicht nur zum besseren Verständnis der Bildung und Funktion der Zellkraftwerke bei – sie liefert auch neue Einsichten über die Bildung von Chloroplasten und Bakterien.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Alexandra I. C. Höhr, Caroline Lindau, Christophe Wirth, Jian Qiu, David A. Stroud, Stephan Kutik, Bernard Guiard, Carola Hunte, Thomas Becker, Nikolaus Pfanner, Nils Wiedemann; "Membrane protein insertion through a mitochondrial β-barrel gate"; Science; 2018; 359/6373.
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Hahnemühle LifeScience Katalog Industrie & Labor von Hahnemühle
Große Vielfalt an Filterpapieren für alle Labor- und industrielle Anwendungen
Filtrationslösungen im Bereich Life Sciences, Chemie und Pharma

Polyethersulfone Ultrafilter von Sartorius
Zuverlässige Filtration mit PESU-Membranen
Perfekt für Biotechnologie und Pharma, widersteht Sterilisation und hohen Temperaturen

Hydrosart® Microfilter von Sartorius
Hydrophile Mikrofilter für Bioprozesse
Minimale Proteinadsorption und hohe Durchflussraten

Sartobind® Rapid A von Sartorius
Effiziente Chromatographie mit Einweg-Membranen
Steigern Sie die Produktivität und senken Sie Kosten mit schnellen Zykluszeiten

Sartopore® Platinum von Sartorius
Effiziente Filtration mit minimaler Proteinadsorption
Reduziert Spülvolumen um 95 % und bietet 1 m² Filtrationsfläche pro 10"

Hydrosart® Ultrafilter von Sartorius
Effiziente Ultrafiltration für Biotech und Pharma
Maximale Durchflussraten und minimaler Proteinverlust mit Hydrosart®-Membranen

Polyethersulfone Microfilter von Sartorius
Biotechnologische Filtration leicht gemacht
Hochstabile 0,1 µm PESU-Membranen für maximale Effizienz

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Cholesterin wichtiges Puzzleteil der Fettverbrennung
Deutsch-französische Kooperation in der europaweiten Bekämpfung der "Vogelgrippe"

Nano-Ampel zeigt Risiko an

Roche beendet Partnerschaft mit Atea für Corona-Pille - Roche will Entwicklung anderer Covid-19-Behandlungs- und Diagnoseoptionen fortsetzen
CyBio und IOM schließen Kooperationsvereinbarung - Ausbau der Kompetenz im Plate Reading durch die Vermarktung von Fluoreszenz-Detektionstechnik
Epidauros erfolgreich mit Patenten für Molekulardiagnostik

Chemie 4.0: Unternehmen unter Zugzwang - Digitaler Wandel wirkt sich stark auf die Wettbewerbsfähigkeit der Chemieindustrie aus
Wasserstoffübertragung: Eins nach dem Anderen - Schrittweiser Hydrid-Transfer bei der Biosynthese von Chlorophyll

SCP Seitz Chromatographie Produkte GmbH - Weiterstadt, Deutschland

Dermapharm AG - Gruenwald, Deutschland