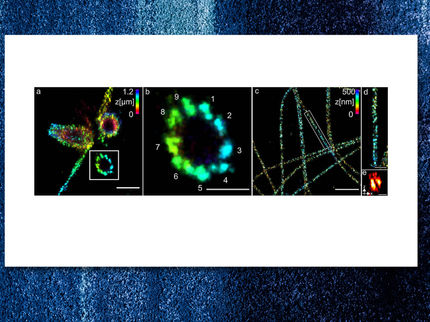
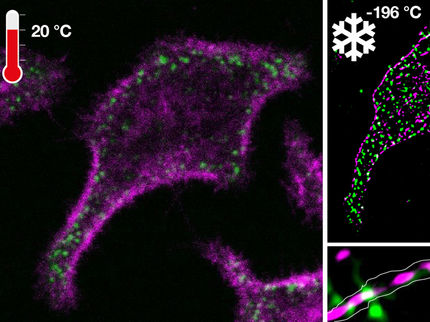
Markus Sauers spezielle Mikroskopie
Einzelne Moleküle und ihre Dynamik in lebenden Zellen sichtbar machen: Das ist das Ziel von Professor Markus Sauer. Um es zu erreichen, entwickelt der neue Inhaber des Lehrstuhls für Biotechnologie und Biophysik der Universität Würzburg neueste Techniken der Fluoreszenz-Mikroskopie mit hoher zeitlicher und räumlicher Auflösung.
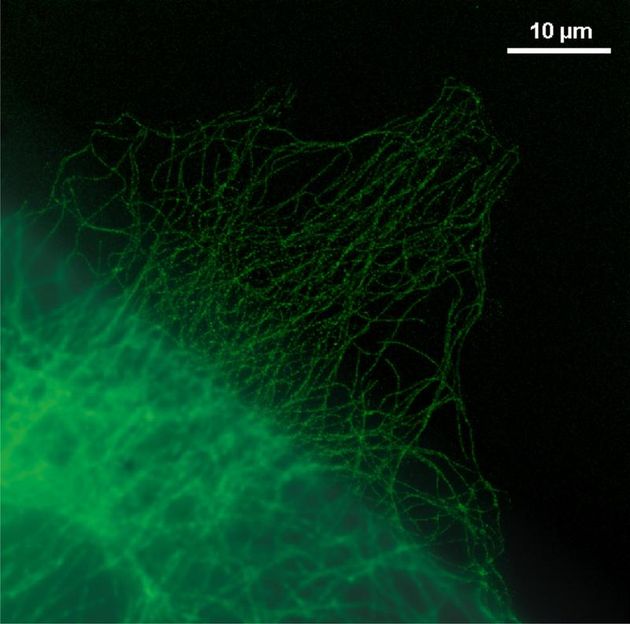
Sichtbar gemacht ist hier das Zellskelett, dessen Gerüst aus Mikrotubulin mit fluoreszierenden Farbstoffen markiert wurde. Unten links ist das Ergebnis zu sehen, das die herkömmliche Fluoreszenz-Mikroskopie liefert, oben rechts die Aufnahme mit der superaufgelösten Variante dieser Technik (dSTORM: direct stochastic optical reconstruction microscopy), entwickelt von Professor Markus Sauer von der Universität Würzburg.
Markus Sauer
Erst Chemiker, dann Physiker, jetzt Biologe: Das fachübergreifende Arbeitsgebiet von Markus Sauer macht's möglich. Der gebürtige Pforzheimer, Jahrgang 1965, studierte Chemie in Saarbrücken, Karlsruhe und Heidelberg. In der Stadt am Neckar promovierte er 1995 dann im Fach Physikalische Chemie.
Sauer war einer der ersten Wissenschaftler, die 1998 mit dem hoch dotierten Bio-Future-Preis des Bundesforschungsministeriums ausgezeichnet wurden. Das ermöglichte es ihm, an der Universität Heidelberg eine unabhängige Forschungsgruppe zu gründen: Sie befasste sich mit der Mikroskopie und Spektroskopie einzelner Moleküle.
2003 wurde Markus Sauer auf den Lehrstuhl für Laserphysik der Universität Bielefeld berufen. Von dort folgte er schließlich dem Ruf ans Biozentrum der Universität Würzburg, wo er die Nachfolge von Professor Ulrich Zimmermann antritt.
Mikroskopische Bilder dank Fluoreszenz
Wie Fluoreszenz-Mikroskopie funktioniert? DNA, Proteine oder andere Moleküle in der Zelle werden spezifisch mit fluoreszierenden Farbstoffen markiert. "Beschießt" man die Zelle dann mit Lichtpulsen, leuchten die markierten Moleküle auf und lassen sich mit technischen Tricks sichtbar machen.
Markus Sauer und sein Team arbeiten daran, diese Mikroskopiertechnik noch empfindlicher zu machen und ihre zeitliche und räumliche Auflösung weiter zu verbessern. Denn sie wollen nicht nur den Aufenthaltsort der Moleküle aufspüren, sondern auch ihre Bewegungen und ihre Wechselwirkungen mit anderen Molekülen.
Fortschritt durch optisch schaltbare Farbstoffe
Wer mit dem Fluoreszenz-Mikroskop viele einzelne Moleküle sichtbar machen will, etwa die unzähligen Histon-Proteine, mit denen die DNA im Zellkern verpackt ist, steht vor einer Herausforderung: Wenn all diese Proteine gleichzeitig aufleuchten, sieht man im Mikroskop nur einen verwaschenen Lichtfleck - die Proteine liegen so nah beieinander, dass ihre Lichtsignale sich überlappen.
"Das ist wie bei einem Kreuzfahrtschiff, auf dem in allen Kabinen gleichzeitig das Licht an ist", vergleicht Sauer. "Aus zu großer Entfernung sieht das Auge dann auch nur einen einzigen Lichtfleck." Würde man aber die Lichter an Bord einzeln und nur für kurze Zeit anschalten, ließe sich die Position jeder Kabine genau bestimmen. "Falls sich das Schiff dabei bewegt, muss das natürlich schnell gehen, damit die Lichtsignale nicht verschmieren."
Diese Strategie wendet Sauers Forschungsteam an - mit Fluoreszenz-Farbstoffen, die sich durch Lichtsignale an- und ausschalten lassen. Durch die wiederholte Bestrahlung mit Licht unterschiedlicher Wellenlängen wird immer nur ein bestimmter Teil der Farbstoffe zum Leuchten gebracht. Auf diese Weise ergeben sich deutlich schärfere Bilder von den Zuständen in der Zelle.
Fluoreszenz-Mikroskopie an lebenden Zellen
Optisch schaltbare Fluoreszenz-Farbstoffe gab es bislang nur wenige. Außerdem funktionierten sie nicht in Anwesenheit von Sauerstoff - so ließen sich bisher nur tote Zellen auf diese Weise mikroskopieren. Sauers Team hat eine Methode entwickelt, dank der sich die meisten kommerziell erhältlichen Fluoreszenz-Farbstoffe als Fotoschalter einsetzen lassen - der Zusatz spezieller Thiolverbindungen macht's möglich. Diese Verbindungen schalten zudem den störenden Effekt von Sauerstoff aus, ohne die Lebensprozesse in der Zelle zu stören.
Die neue Methode nennt Sauer direct stochastic optical reconstruction microscopy (dSTORM). Sein Fazit: "Wir können damit unter physiologischen Bedingungen im Bereich des sichtbaren Lichts super aufgelöste Fluoreszenzbilder mit konventionellen Farbstoffen aufnehmen."
Proteinfaltung: ein spannendes Forschungsfeld
Mit seiner Mikroskopie-Methode erforscht Professor Sauer unter anderem den Prozess der Proteinfaltung. Davon erhofft er auch Fortschritte für die Medizin. Denn die Alzheimer- und die Parkinson-Krankheit sowie andere Leiden entstehen, wenn Proteine - oft nur geringfügig - ihre Struktur ändern und dann verklumpen. "Warum das geschieht, versteht bis heute niemand", so Sauer.
Proteine bestehen aus Aminosäure-Ketten, die sich in unterschiedlicher Weise zu komplexen dreidimensionalen Gebilden falten. Dieser Prozess ist rasend schnell und braucht oft nur Millionstel bis Tausendstel Sekunden. Sauers Gruppe hat Techniken entwickelt, um ihn trotzdem unter dem Fluoreszenz-Mikroskop beobachten zu können.
Viel Faszinierendes ist dabei schon herausgekommen: "Proteine sind in ständiger Bewegung, sie tasten sogar regelrecht die Umgebung ab auf der Suche nach ihren Bindungspartnern", berichtet Sauer. Mindestens 30 Prozent aller Proteine seien unstrukturiert, solange sie keine Bindung eingehen. Erst wenn der Kontakt hergestellt ist, nehmen sie ihre eigentliche Gestalt an.