Biogene Insektizide entschlüsselt
Freiburger Forscher entdecken Wirkmechanismus insektizider Toxine
Forscher der Universität Freiburg berichten in Science (Band 327, S. 1139-1142) von der Entdeckung eines neuen Wirkmechanismus insektizider Toxine aus Photorhabdus luminescens, einem Keim der symbiotisch mit Nematoden lebt. Die winzigen Würmer dringen durch natürliche Öffnungen in Insektenlarven ein, wo sie die Bakterien gewissermaßen wieder „herauswürgen“. Bakterielle Toxine, die von den Licht-aussendenden Keimen produziert werden, töten die Insektenlarven und schaffen dadurch ein großes Nahrungsreservoir für die Vermehrung von Nematoden und Bakterien. Deshalb werden die Würmer mit ihren Bakterien als biogene Insektizide eingesetzt.
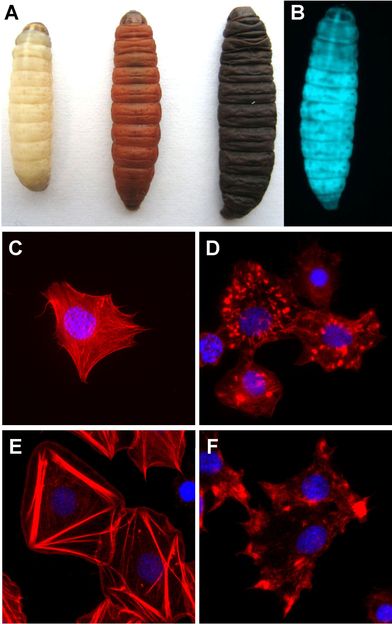
Galleria mellonella (Große Wachsmotte) infiziert mit Photorhabdus luminescens. (A) Larven der Großen Wachsmotte nach Infektion mit P. luminescens, Links, nicht-infiziert; Mitte, nach 24 Stunden; rechts, nach 48 Stunden. (B) Biolumineszens von P. luminescens. Nach der Infektion der Insektenlarven beginnt P. luminescens zu leuchten. (C-F) Wirkung der P. luminescens Toxine auf isolierte primäre Blutzellen (Hämozyten) von Galleria mellonella. Kontrollzellen (C), mit TccC3 (D), TccC5 (E) und TccC3 + TccC5 (F) behandelt. Die beiden Toxine zerstören das Zytoskelett von Zielzellen.
©Alexander E. Lang
Photorhabdus luminescens produziert verschiedene Toxine, die große Toxin-Komplexe (Tc-Proteine) bilden. Der biologisch aktive Komplex besteht dabei aus den drei Komponenten TcA, TcB und TcC. Bis heute ist weder eine enzymatische Aktivität noch ein Wirkungsmechanismus für diese Toxine beschrieben worden. Die Freiburger Forscher um Prof. Dr. Dr. Klaus Aktories und Prof. Dr. Gudula Schmidt untersuchten zusammen mit Forschern der Firma Dow AgroSciences (USA) und Prof. Dr. Hans Georg Mannherz (Universität Bochum beziehungsweise Max-Planck-Instituts für molekulare Physiologie in Dortmund) die Wirkungen der Toxine auf Insekten- und Säugetierzellen.
Dabei konnte gezeigt werden, dass die biologische Aktivität in den TcC-Komponenten TccC3 und TccC5 lokalisiert ist. Die beiden Toxinkomponenten sind Enzyme, die essentielle Abwehrfunktionen von Immunzellen wie zum Beispiel die Aufnahme und Abtötung von Bakterien hemmen. Die Toxine wirken dabei auf zwei unterschiedlichen Wegen auf die Zielzellen der Insektenlarven. TccC3 modifiziert direkt das Zytoskelettprotein Aktin an der Aminosäure Threonin-148 durch Anhängen von ADP-Ribose. Hierdurch wird ein Regulator des Aktins (Thymosin-β4) verdrängt und es resultiert eine stark vermehrte Polymerisation des Zytoskelettproteins. Das zweite Toxin, TccC5, verändert Rho-Proteine, die Schalterproteine für die Regulation des Aktinzytoskeletts sind. Diese Regulatoren werden in der Zelle an- und wieder ausgeschaltet. TccC5 modifiziert den Schalter an der Aminosäure Glutamin-63 ebenfalls durch Anhängen von ADP-Ribose. Dadurch wird das Ausschalten blockiert. Das permanent aktive Rho-Protein fördert wiederum die Polymerisation von Aktin. Beide Toxine zusammen führen zu einer starken Aggregation und Clusterbildung des Aktinzytoskeletts, die mit der normalen zellulären Funktion oder Immunabwehr unvereinbar ist. Damit die Toxine TccC3 und TccC5 in die Insektenzellen gelangen können, wird TcA gebraucht, das Poren in Wirtszellen bildet durch die wahrscheinlich die Toxine ins Zellinnere geschleust werden.
Tc-Proteine wurden auch in humanpathogenen Bakterien wie zum Beispiel Yersinia pseudotuberculosis und Yersinia pestis identifiziert. Daher ist die Aufklärung des molekularen Mechanismus der prototypischen Tc-Proteine von entscheidender Bedeutung für das Verständnis anderer Tc-Proteine aus Insektiziden und humanpathogenen Bakterien.
Originalveröffentlichung: Alexander E. Lang, Gudula Schmidt, Andreas Schlosser, Timothy D. Hey, Ignacio M. Larrinua, Joel J. Sheets, Hans G. Mannherz und Klaus Aktories; "Photorhabdus luminescens Toxins ADP-Ribosylate Actin and RhoA to Force Actin Clustering“; Science 2010.