Biogene Insektizide entschlüsselt
Forscher klären Wirkmechanismus von Tc-Proteinen auf
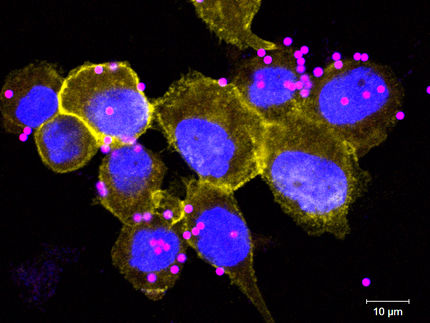
Nematoden, winzige Würmer, dienen dem Keim Photorhabdus luminescens als Transportmittel, um in Insektenlarven zu gelangen. Da er die Larven tötet, werden die Würmer mit den Bakterien als Insektizid eingesetzt. Der genaue Wirkmechanismus von Photorhabdus luminescens war bis her ungeklärt. Gemeinsam mit Kollegen aus Freiburg konnte Prof. em. Dr. Hans Georg Mannherz (Medizinische Fakultät der RUB und Max-Planck-Institut für Molekulare Physiologie, Dortmund) ihn jetzt entschlüsseln: Maßgeblich beteiligt sind bestimmte Untereinheiten des Toxinkomplexes, die essentielle Abwehrreaktionen von Immunzellen hemmen. Der gleiche Mechanismus wirkt auch bei einigen für Menschen gefährlichen Keimen wie dem Erreger von Lungen- und Beulenpest.
Würmer bringen Bakterien ans Ziel
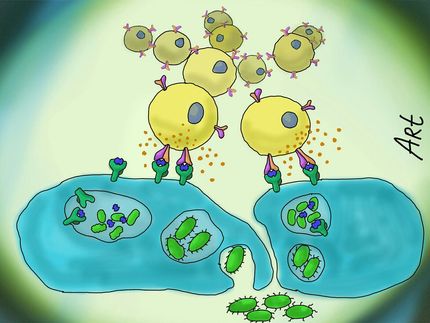
Photorhabdus luminescens lebt symbiotisch mit Nematoden. Die winzigen Würmer dringen durch natürliche Öffnungen in Insektenlarven ein, wo sie die Bakterien gewissermaßen wieder "herauswürgen". Bakterielle Toxine, die von dem Licht-emittierenden Keim produziert werden, töten die Insektenlarven und schaffen dadurch ein großes Nahrungsreservoir für die Vermehrung von Nematoden und Bakterien.
Zwei Untereinheiten des Toxinkomplexes sind biologisch aktiv
Photorhabdus luminescens produziert verschiedene Toxine, die große Toxin-Komplexe (Tc-Proteine) bilden. Der biologisch aktive Komplex besteht dabei aus den drei Komponenten TcA, TcB und TcC. Bis heute ist weder eine enzymatische Aktivität noch ein Wirkungsmechanismus für diese Toxine beschrieben worden. Die Freiburger Forscher um Prof. Dr. Dr. Klaus Aktories und Prof. Dr. Gudula Schmidt untersuchten zusammen mit Forschern der Firma Dow AgroSciences (USA) und Prof. em. Dr. Mannherz die Wirkungen der Toxine auf Insekten- und Säugetierzellen. Dabei konnten sie zeigen, dass die biologische Aktivität in den TcC-Komponenten TccC3 und TccC5 lokalisiert ist. Die beiden Toxinkomponenten sind Enzyme, die essentielle Abwehrfunktionen von Immunzellen hemmen, zum Beispiel die Phagozytose von Bakterien.
Toxine wirken auf zwei Wegen
Die Toxine wirken dabei auf zwei unterschiedlichen Wegen auf die Zielzellen der Insektenlarven. TccC3 modifiziert das Zytoskelettprotein Aktin (ADP-ribosylierung) derart, dass es sich der Kontrolle des Regulatorproteins Thymosin ß4 entzieht. Dies führt zu einer starken Verkettung (Polymerisation) des Aktins. Das zweite Toxin, TccC5, verändert sog. Rho-Proteine, die Schalterproteine für die Regulation des Aktinzytoskeletts sind. Normalerweise werden diese Regulatoren in der Zelle an- und wieder ausgeschaltet. TccC5 modifiziert den Schalter, wodurch das Ausschalten blockiert wird. Das permanent aktive Rho-Protein fördert wiederum die Polymerisation von Aktin. Beide Toxine zusammen führen zu einer starken Aggregation bis Verklumpung des Aktinzytoskeletts, die mit der normalen zellulären Funktion oder Immunabwehr unvereinbar ist. Damit die Toxine TccC3 und TccC5 in die Insektenzellen gelangen können, wird TcA gebraucht, das Poren in Wirtszellen bildet, durch die wahrscheinlich die Toxine ins Zellinnere geschleust werden.
Entscheidende Erkenntnisse für das Verständnis von Tc-Proteinen
Tc-Proteine wurden auch in humanpathogenen Bakterien wie z.B. Yersinia pseudotuberculosis und Yersinia pestis identifiziert. "Daher ist die Aufklärung des molekularen Mechanismus der prototypischen Tc-Proteine von entscheidender Bedeutung für das Verständnis anderer Tc-Proteine aus insektiziden und humanpathogenen Bakterien", erklärt Prof. Mannherz.
Originalveröffentlichung: Alexander E. Lang, Gudula Schmidt, Andreas Schlosser, Timothy D. Hey, Ignacio M. Larrinua, Joel J. Sheets, Hans G. Mannherz und Klaus Aktories; "Photorhabdus luminescens Toxins ADP-Ribosylate Actin and RhoA to Force Actin Clustering"; Science 2010, 327: 1139-1142.
Meistgelesene News
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte

Die Vermessung der Nanowelt - Forscher etablieren einen Maßstab zur genauen Bestimmung von Abständen innerhalb einzelner Moleküle

Tacalyx GmbH - Berlin, Deutschland

Verblüffender Zusammenhang zwischen Ernährung, Augengesundheit und Lebenserwartung - "Die Erkenntnis, dass das Auge selbst, zumindest bei der Fruchtfliege, die Lebensspanne direkt regulieren kann, hat uns überrascht"

Wichtige epigenetische Marker für die Anfälligkeit für die Entwicklung von Esssucht identifiziert - Die im Mäusegehirn betroffenen epigenetischen Marker waren auch im Plasma von Menschen verändert
Molekularer Schalter gegen akute Leberentzündung - Hoffnungen auf eine bessere Therapie bei akuter Hepatitis und geringere Transplantationsrate bei betroffenen Patienten

Das alternde Gehirn: Protein-Kartierung liefert neue Erkenntnisse - Forschende der LMU und des Exzellenzclusters SyNergy haben analysiert, wie sich das Proteom bestimmter Hirnzellen im Alter verändert
Röntgenkamera beobachtet Gen-Schalter in Aktion - Neue Methode zur Untersuchung biochemischer Reaktionen

Forschende „filmen“ die Aktivierung eines wichtigen Rezeptors - Studie könnte zur Entwicklung besserer Medikamente beitragen