Wie Protein Überleben von Krebszellen begünstigt
Einem internationalen Forscherteam unter Beteiligung von Anke Roth und Prof. Christoph Arenz vom Institut für Chemie der Humboldt-Universität zu Berlin ist ein wichtiger Einblick in die Wirkungsweise des Proteins Hsp 70 gelungen, das möglicherweise das Absterben von Krebszellen hemmt.
Das Protein ist ein sogenanntes molekulares Chaperon. Es stellt das Überleben von Zellen unter ungünstigen äußeren Bedingungen wie beispielsweise Stress sicher. Zellen antworten normalerweise auf fortdauernden Stress mit der Einleitung des programmierten Zelltods. Das Absterben von Zellen kann einerseits im Zusammenhang mit entzündlichen Erkrankungen fatale Folgen bis hin zum Organversagen haben. Andererseits ist der programmierte Zelltod sehr wichtig für eine Vielzahl von Prozessen. Eine verminderte oder fehlende Befähigung zum programmierten Zelltod ist beispielsweise auch ein entscheidendes Charakteristikum von Krebszellen. Daher ist die Frage, auf welche Weise Hsp70 dieser wichtigen zellulären Antwort, beispielsweise bei einer Strahlentherapie von Tumoren, entgegenwirkt, für Wissenschaftler von besonderem Interesse.
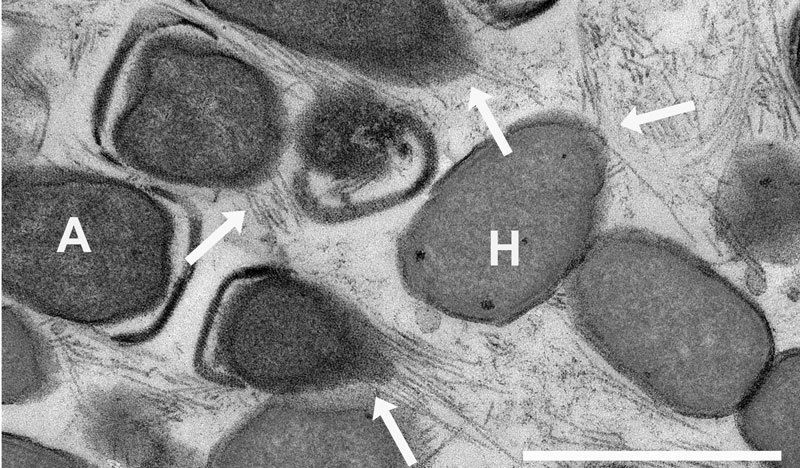
Die Biologin Marja Jäättelä vom Dänischen Krebs-Zentrum in Kopenhagen hat herausgefunden, dass dieses Protein bei zellulärem Stress oder auch in Krebszellen in bestimmte Bereiche der Zelle, die sogenannten Lysosomen gelangt. Die Berliner Forscher konnten dabei nachweisen, dass Hsp70 innerhalb der Lysosomen an ein definiertes Lipid bindet und offenbar gerade dadurch zum Überleben der Zellen beiträgt. Dies ist besonders interessant, da es bereits pharmakologische Wirkstoffe gibt, die diesem Überlebensmechanismus entgegenwirken könnten, da sie an das besagte Lipid binden und dadurch die Anbindung des Hsp70 verhindern. Derartige Wirkstoffe könnten daher für zukünftige Krebstherapien beispielsweise in Kombination mit einer Strahlen- oder Chemotherapie interessant sein.
Auch bei der tödlich verlaufenden Stoffwechsel-Erkrankung Morbus Niemann-Pick spielt das molekulare Chaperon eine Rolle, hier könnte es möglicherweise einen therapeutischen Effekt haben. Die HU-Wissenschaftlerin Anke Roth fand in ihren Experimenten heraus, dass Hsp70 überraschenderweise auch mit dem Enzym ASM (acid sphingomyelinase) interagiert. Hsp70 und ASM aktivieren sich offenbar gegenseitig. Bei Patienten der Niemann-Pick-Krankheit ist die ASM-Aktivität jedoch zu niedrig. In ihren Zellen kann Hsp70 seine schützende Wirkung für die Zelle offenbar nicht voll entfalten; nach den neuesten Erkenntnissen möglicherweise, weil die aktivierende Wirkung der ASM fehlt. Entscheidend könnte die Beobachtung sein, dass verabreichtes Hsp70 in Zellen von Niemann-Pick-Patienten die Aktivität von ASM stark heraufsetzen kann. Auch wenn ASM und Hsp70 gemeinsam gegeben wurden, hatte Hsp70 einen verstärkenden Effekt auf ASM. Die Verabreichung von ASM alleine wird zurzeit unter anderem in den USA und Deutschland an Patienten der Niemann-Pick-Krankheit als Behandlungsoption klinisch erprobt. Hier könnte also die gemeinsame Gabe von ASM und Hsp70 einen therapeutischen Effekt deutlich verstärken.
Die Herstellung von Wirkstoffen zur Behandlung der Niemann-Pick Krankheit ist ein Ziel, das sich die Arbeitsgruppe von Prof. Arenz schon seit längerem auf die Fahnen geschrieben hat. In einem von der Volkswagenstiftung seit 2006 geförderten Projekt versuchen die Forscher auf der Basis von kleinen Molekülen, Chaperone auf chemischen Weg zu entwickeln, die gezielt die ASM stabilisieren und aktivieren können. Diese kleinen Moleküle könnten vielleicht eine ähnliche Wirkung auf Zellen von Niemann-Pick-Patienten haben, wie sie nun für das Hsp70 entdeckt wurde. Anders als das Protein Hsp70, das im Falle einer therapeutischen Verwendbarkeit intravenös verabreicht werden müsste, könnten die kleinen Moleküle vermutlich einfach in Form von Tabletten eingenommen werden.
Original Publikation: T. Kirkegaard, A. G. Roth, N. H. T. Petersen, A. K. Mahalka, O. D. Olsen, I. Moilanen, A. Zylicz, J. Knudsen, K. Sandhoff, C. Arenz, P. K. J. Kinnunen, J. Nylandsted, M. Jäättelä; "Hsp70 stabilizes lysosomes and reverts Niemann-Pick disease-associated lysosomal pathology."; Nature 2010.