Falsch gefaltete Fasern
Schockgefroren unter dem Elektronenmikroskop: mechanische Eigenschaften von Alzheimer-Amyloidfibrillen unter der Lupe
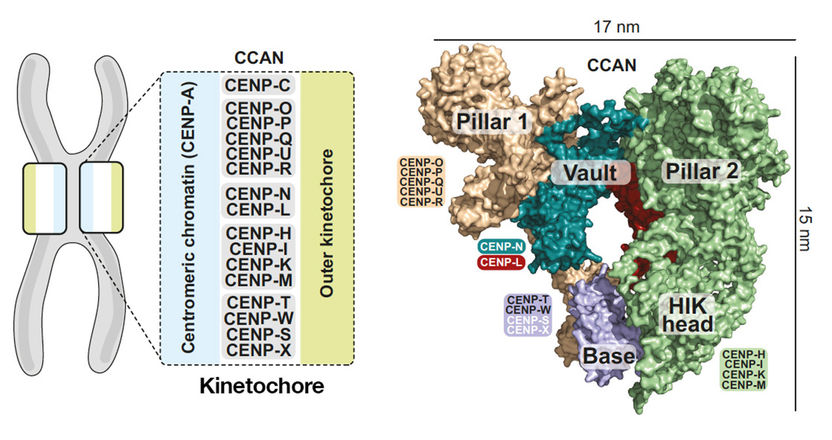
Alzheimer, Parkinson, Typ-II-Diabetes und Prionenerkrankungen wie BSE stehen in Zusammenhang mit der Ablagerung von Amyloidfibrillen in Geweben und Organen. Dabei handelt es sich um faserartige Verklumpungen falsch gefalteter Eiweiße, deren genaue Struktur und Rolle in den pathologischen Prozessen bislang noch nicht umfassend verstanden sind. Anhand elektronenmikroskopischer Aufnahmen schockgefrorener Proben untersuchten Forscher jetzt die genaue Struktur von Alzheimer-Amyloidfibrillen und schätzen ihre mechanischen Eigenschaften ab. Wie das Team in der Zeitschrift Angewandte Chemie berichtet, sind diese Fibrillen sehr steif – eine der wesentlichen Ursachen für ihre Pathogenität.
Weil sich Amyloidfibrillen mit traditionellen biophysikalischen Verfahren nur schwer analysieren lassen, mussten Marcus Fändrich (Max-Planck-Forschungsstelle für Enzymologie der Proteinfaltung, Halle/Saale), Carsten Sachse (MRC Laboratory of Molecular Biology, Cambridge, Großbritannien) und Nikolaus Grigorieff (Brandeis University, Waltham, USA) anders vorgehen: Sie untersuchten Alzheimer-Amyloidfibrillen mithilfe der Kryoelektronenmikroskopie. Die Proben werden dabei innerhalb von Sekundenbruchteilen schockgefroren und dann elektronenmikroskopisch untersucht. „Diese Experimente ermöglichten es uns, die Struktur der Fibrillen mit einer bislang nicht erreichten Auflösung zu untersuchen,“ erläutert Fändrich.
Die Fibrillen erscheinen als etwa 20 nm breite verdrillte Bänder, die in den kryo-elektronenmikroskopischen Rohaufnahmen oft verbogen sind. „Diese unterschiedlich verbogenen Fibrillen sind sozusagen Momentaufnahmen der Fibrillen in Lösung,“ sagt Fändrich. „Anhand der unterschiedlichen Verbiegungen und Verdrillungen errechneten wir, wie steif die Fibrillen sind“. Dabei zeigte sich, dass die Alzheimer-Amyloidfibrillen relativ starre Strukturen darstellen. „Die unkontrollierte Bildung solch steifer Fibrillen ist vermutlich für die Pathogenität von Amyloidfibrillen von entscheidender Bedeutung,“ berichtet Fändrich. „Bei vielen Amyloiderkrankungen lagern sich die Fibrillen vorzugsweise in Geweben ab, die kontraktil oder elastisch sein müssen, wie etwa dem Herzmuskel oder den Wänden von Blutgefäßen. Medizinische Befunde deuten darauf hin, dass die Fibrillen diese Gewebe versteifen“.
“Außerdem könnten unsere Daten helfen, die Anwendungsmöglichkeiten von Amyloidfibrillen als neuartige Werkstoffe in der Bionanotechnologie besser abzuschätzen,“ berichtet Fändrich. Amyloidfasern stellen nämlich aufgrund ihrer Materialeigenschaften und ihrer leichten Modifizierbarkeit potenziell interessante neuartige Baustoffe dar.
Originalveröffentlichung: Marcus Fändrich, et al.; "Kryoelektronenmikroskopische Bestimmung der nanoskaligen Flexibilität von Amyloidfibrillen"; Angewandte Chemie 2010, 122, No. 7.
Meistgelesene News
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Invasives_duktales_Karzinom
Zukunftspreis-Anwärter: E-Mobilität, Krebstherapie und Zellforschung - Der Deutsche Zukunftspreis ist mit 250.000 Euro dotiert und gehört zu den bedeutendsten Wissenschaftspreisen in Deutschland
Autoantikörper bei COVID-19 weniger schädlich als gedacht? - Vermutlich trifft sie in den meisten Fällen keine Schuld, wenn es den Patienten besonders schlecht ergeht