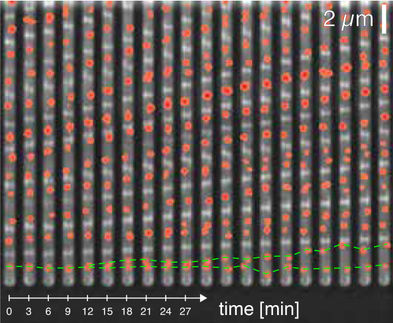
Neue Anwendungen in lebenden Zellen: Nanobodies verändern die Form und Funktion von Proteinen
Binden Antikörper des Immunsystems an Proteine, können sie deren Form - und damit auch die Funktion dieser Moleküle - verändern. Einem LMU-Team um Professor Heinrich Leonhardt vom Biozentrum, Professor Karl-Peter Hopfner vom Genzentrum und dem Biologen Dr. Ulrich Rothbauer, Geschäftsführer des Biotechnologieunternehmen ChromoTek, gelang hier nun ein Durchbruch: Die Forscher konnten zeigen, dass unkonventionell kleine Antikörper, die sogenannten Nanobodies, die Eigenschaften des Grün Fluoreszierenden Proteins, kurz GFP, mit unerwarteter Präzision modifizieren.
GFP wird mit anderen Proteinen fusioniert, um diese in lebenden Zellen verfolgen zu können. Die Einsatzmöglichkeiten des Moleküls erweitern sich nun mit Hilfe der Nanobodies beträchtlich. Ganz neuartige experimentelle Ansätze sind zudem denkbar, weil die Studie auch zeigen konnte, wie die Nanobodies im strukturellen Detail auf die Proteine wirken.
Antikörper sind spezialisierte Moleküle, die Fremdkörper im Organismus als Ziele für eine Immunattacke markieren. Weil sie hochspezifisch an fast jede chemische Struktur binden können, werden sie auch in der Forschung und in der Therapie genutzt. Konventionelle Antikörper aber sind zu groß, um in lebenden Zellen zum Einsatz zu kommen. Eine Alternative bieten Kamele und ihre südamerikanischen Verwandten, die Alpakas Guanakos, Lamas und Vicunjas: Diese Tiere produzieren auch sehr viel kleinere Antikörper, aus deren Erkennungsdomäne sogenannte Nanobodies gebildet werden, die auch in Zellen funktionieren.
Das LMU-Team arbeitete mit Kollegen der TU Darmstadt, der Freien Universität in Brüssel und des LMU-Spinoffs ChromoTek zusammen, um Nanobodies zu erzeugen, die spezifisch auf GFP reagieren: Zunächst wurden Alpakas mit GFP immunisiert. Dann wurde die genetische Information für Antikörper - auch jener, die GFP erkennen - in Bakterien übertragen. "Diese Antikörperfragmente wurden dann von den Bakterien synthetisiert und konnten getestet werden, ob sie an GFP binden", erklärt Rothbauer. "Insgesamt konnten wir sieben passende Nanobodies auf diesem Weg identifizieren."
GFP ist geformt wie eine Tonne, die an beiden Enden offen ist. In ihrem Inneren bildet sich spontan das sogenannte Chromophor. Diese lichtabsorbierende Struktur ist für die Erzeugung der Fluoreszenz nötig. Die Absorption von Licht lässt grüne Fluoreszenz entstehen, wobei die Antwort von der genauen Konformation des Proteins abhängt. Zwei Nanobodies hatten einen deutlichen Einfluss auf diesen Zusammenhang. "Ein Nanobody verstärkte durch seine Bindung die Fluoreszenz um das Fünffache", berichtet Rothbauer. "Der andere hat sie dagegen um den Faktor vier reduziert, so dass wir das Signal ein- und ausschalten konnten." Wie dies gelingt, zeigten Strukturanalysen am Genzentrum der LMU. "Unsere Untersuchungen haben ergeben, dass ein Nanobody eine bestimmte Region des Proteins näher an das Chromophor drückt, während der andere es eher wegschiebt", sagt Erstautor Axel Kirchhofer.
In einem weiteren Experiment prüften die Forscher, ob der verstärkende Nanobody auch als Sensor für GFP-fusionierte Proteine in der Zelle dienen könnte. Dazu nutzten sie Zellen, die einen GFP-gebundenen Hormonrezeptor im Zellinneren produzieren. Der Nanobody wurde dagegen an der Innenseite der Membran des Zellkerns synthetisiert. Die Zugabe des passenden Hormons ließ dann den Rezeptor in den Zellkern wandern. "Wir konnten diesen Prozess durch eine Messung der Fluoreszenz verfolgen, die durch die Bindung des Nanobody an das GFP induziert wurde", so Rothbauer. "Diese erfolgreiche Kooperation zwischen Zell- und Strukturbiologen hat den Nachweis geliefert, dass Nanobodies verschiedene Proteinkonformationen erkennen, induzieren und stabilisieren, was sie für den Einsatz in lebenden Zellen prädestiniert."
Originalveröffentlichung: Axel Kirchhofer et al.; "Modulation of protein properties in living cells using nanobodies"; Nature Structural and Molecular Biology online, 13. Dezember 2009
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Antikörper
Antikörper sind spezialisierte Moleküle unseres Immunsystems, die gezielt Krankheitserreger oder körperfremde Substanzen erkennen und neutralisieren können. Die Antikörperforschung in Biotech und Pharma hat dieses natürliche Abwehrpotenzial erkannt und arbeitet intensiv daran, es therapeutisch nutzbar zu machen. Von monoklonalen Antikörpern, die gegen Krebs oder Autoimmunerkrankungen eingesetzt werden, bis hin zu Antikörper-Drug-Konjugaten, die Medikamente gezielt zu Krankheitszellen transportieren – die Möglichkeiten sind enorm.
Themenwelt Antikörper
Antikörper sind spezialisierte Moleküle unseres Immunsystems, die gezielt Krankheitserreger oder körperfremde Substanzen erkennen und neutralisieren können. Die Antikörperforschung in Biotech und Pharma hat dieses natürliche Abwehrpotenzial erkannt und arbeitet intensiv daran, es therapeutisch nutzbar zu machen. Von monoklonalen Antikörpern, die gegen Krebs oder Autoimmunerkrankungen eingesetzt werden, bis hin zu Antikörper-Drug-Konjugaten, die Medikamente gezielt zu Krankheitszellen transportieren – die Möglichkeiten sind enorm.