Bewegungen von Viren auf Membranen live verfolgen
Wissenschaftler am Center for Imaging Science and Technology (CIMST) der ETH Zürich haben eine neue Methode entwickelt, die es erstmals ermöglicht, in Echtzeit kleinste Bewegungen von Viren zu verfolgen. So konnten die Forschenden zeigen, dass Viren auf künstlichen Membranen rutschen, rollen und manchmal sogar festkleben.
Fluoreszierende Markierungen helfen die Bewegungen von Viren auf Membranen zu verfolgen.
ETH Zürich/Philipp Kukura
Damit der Zuschauer zu Hause gleichzeitig mit dem Schiedsrichter entscheiden kann, ob der Fussball vor oder hinter der Torlinie liegt, ist er angewiesen auf qualitativ gute Live-Bilder. Das gleiche gilt für Wissenschaftler, die kleinste Objekte wie beispielsweise Viren untersuchen. Was bei einer Fussballübertragung eine Selbstverständlichkeit ist, stellte die Wissenschaft bislang vor große technische Probleme. Denn mit dem Elektronenmikroskop konnten Forschende zwar genau herausfinden wo sich Viren befinden, jedoch keine Bewegungen aufzeichnen. Und mit dem optischen Mikroskop konnten sie ermitteln, in welche Richtung sich ein Virus bewegt, jedoch nicht zeigen, wie genau Viren auf einer Membran agieren. Offen blieben zwei Fragen: Rutscht ein Virus auf der Zellmembran, weil es sich an diesen Rezeptoren festhält oder rollt es wie ein Fussball auf dem Rasen, in dem es sich ständig an neue Rezeptoren anhängt?
Mit Lichtmarkierung zum Erfolg
Wissenschaftler um Vahid Sandoghdar, Professor am Labor für Physikalische Chemie der ETH Zürich haben nun eine Methode entwickelt, mit der sie erstmals beobachten konnten, wie Viren mit den Rezeptoren einer Wirtszelle interagieren - auf einen Nanometer genau und in Echtzeit. In einer interdisziplinären Zusammenarbeit mit Ari Helenius, Professor am Institut für Biochemie und seinen Mitarbeitenden zeigen sie zum ersten Mal, dass Viren auf Membranen teilweise rollen und teilweise rutschen.
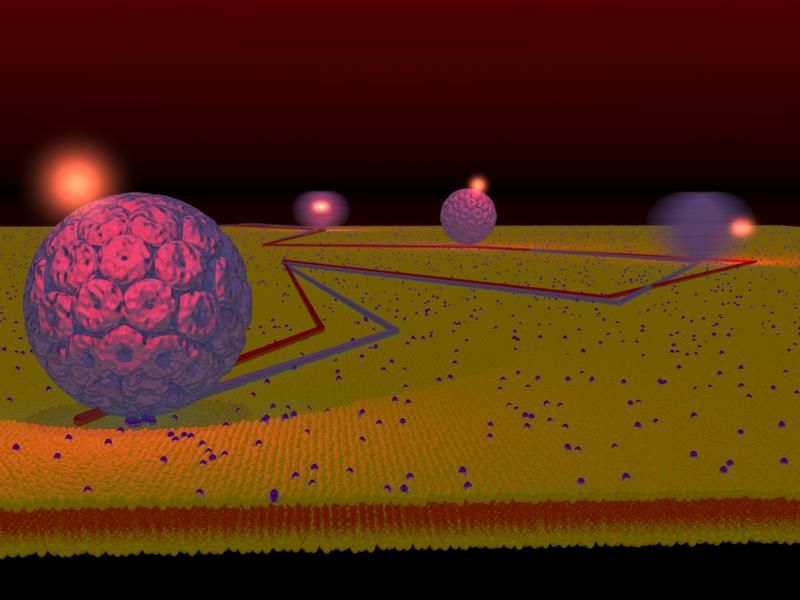
Die Wissenschaftler wählten für ihre Untersuchungen das 45 Nanometer kleine "Simian Virus 40" aus der Familie der Polyoma-Viren. Um die Forschung zu vereinfachen, stellten sie künstliche Membranen her und statteten diese mit gleichartigen Zellrezeptoren aus. Anschließend hängten sie eine einzige fluoreszierende Markierung an das Virus. Sie bestimmten dann den Schwerpunkt des Virus mit einer empfindlichen Streulichtmethode und jenen der Markierung mit Hilfe der Fluoreszenz. Mit diesen beiden Schwerpunkten konnten sie in Echtzeit verfolgen, wie sich das Virus bewegt und ausrichtet. "Die Methode lässt sich am einfachsten mit dem Beispiel eines Fussballs erklären", sagt Dr. Philipp Kukura, wissenschaftlicher Mitarbeiter am Labor für Physikalische Chemie und Erstautor der Studie. "Das Virus ist vergleichbar mit einem Fussball ohne Muster, von dem man nicht wusste wie er sich genau bewegt. Wir haben einen Weg gefunden, ein helles Licht an den Ball zu hängen und sehr schnell und genau hingeschaut, wie er sich bewegt."
Nie dagewesene Präzision
Die Forscher beobachteten, dass das "Simian Virus 40" nicht nur auf der Membran rutschte und rollte, sondern auch manchmal festklebte und hin und her schwankte. "Da das Virus erst in die Zelle eindringt, wenn es am Rezeptor fixiert ist, schließen wir aus Resultaten, dass die Fixierung des Virus von den Rezeptoren beeinflusst wird", erklärt Prof. Vahid Sandoghdar. Die Studie liefert aber nicht nur neue Erkenntnisse über das untersuchte Virus und die Wechselwirkung mit seinen Rezeptoren.
Vahid Sandoghdar verspricht sich von der neuen Methode auch große Fortschritte im Bereich von optischen Sensoren, mit denen Viren, aber auch andere kleinste Teilchen bestimmt werden können. Optische Sensoren funktionieren nach dem folgenden Prinzip: Wissenschaftler bestücken Oberflächen mit Rezeptoren für verschiedene Viren und Proteine. Sobald die Viren an die Rezeptoren andocken, wird ein Streulichtsignal ausgesendet. Die Forschenden können Viren so schnell und einfach identifizieren.
Originalveröffentlichung: Kukura P. et al.; "High-speed nanoscopic tracking of the position and orientation of a single virus"; Nature Methods. Published online 1 November 2009