Infektionen durch Epstein-Barr-Viren: Zielstruktur für therapeutische Ansätze identifiziert
Wissenschaftler der Abteilung Genvektoren am Helmholtz Zentrum München konnten zeigen, wie ein spezielles virales Gen den Lebenszyklus von B-Zellen kontrolliert, die mit dem Epstein-Barr-Virus (EBV) infiziert wurden. Das zugehörige Protein stellt eine Zielstruktur für die Krebstherapie dar.
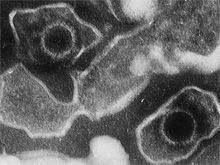
Epstein-Barr-Virus (transmissions- elektronenmikroskopische Aufnahme).
Helmholtz Zentrum München
Forscher der Abteilung Genvektoren des Helmholtz Zentrums München haben eine neue Rolle des Gens EBNA-3A bei EBV-assoziierten bösartigen Erkrankungen entdeckt. „Im Rahmen einer genomweiten Studie konnten wir erstmals Zielgene nachweisen, die durch das zugehörige Protein reguliert werden“, erklärt Dr. Bettina Kempkes, die das Projekt geleitet hat.
Das Epstein-Barr-Virus (EBV), ein Herpesvirus, ist von großer gesundheitlicher Bedeutung - etwa 95 Prozent der Bevölkerung gelten als latent infiziert. Meist verläuft die Erstinfektion eines gesunden Menschen ohne Symptome; eher selten wird das Pfeiffersche Drüsenfieber mit grippeähnlichen Symptomen ausgelöst. Das Spektrum der Folgekrankheiten nach einer Infektion reicht von gutartigen Vermehrungen der Lymphozyten bis hin zu Krebserkrankungen.
Für Transplantatempfänger, deren Immunsystem medikamentös oder durch Bestrahlung ausgeschaltet werden muss, um Abstoßungen zu verhindern, stellt EBV eine große Gefahr dar. Durch eine Reaktivierung des schlummernden Virus oder auch durch eine Neuinfektion kann die Bildung von bösartigen Erkrankungen des Immunsystems verursacht werden, die als Posttransplantations Lymphome (PTLD) bezeichnet werden. Die EBV-infizierten Zellen zeigen dann ein charakteristisches Expressionsprofil sowohl viraler als auch zellulärer Gene.
Ruhende menschliche B-Zellen können durch EBV-Infektionen aktiviert und transformiert werden. Damit gewinnen sie die Fähigkeit, sich in der Zellkultur unbegrenzt zu vermehren. Bei solchen transformierten B-Zellen laufen sehr ähnliche virale und zelluläre Programme ab wie in bösartig veränderten B-Zellen bei Transplantat-Empfängern. All diese Prozesse werden von neun Genen mit verschiedenen Funktionen in einer konzertierten Aktion gesteuert. Der individuelle Beitrag viraler Proteine zu dem komplexen Prozess kann durch gezielte Inaktivierung einzelner Gene im viralen Genom untersucht werden.
In der Abteilung Genvektoren wurde von der Arbeitsgruppe von Prof. Dr. Wolfgang Hammerschmidt bereits 1998 eine Technologie entwickelt, die es ermöglicht, das sehr große Genom des EBV in Bakterienzellen gezielt zu verändern. Mit dieser Technik hat die Arbeitsgruppe von Dr. Bettina Kempkes jetzt das EBNA-3A-Gen im viralen Genom ausgeschaltet. Transformationsstudien mit diesen neuen Viren zeigten, dass EBNA-3A maßgeblich an der Regulation zahlreicher Gene beteiligt ist, die biologische Prozesse wie die Apoptose (den programmierten Zelltod) oder die Regulation des Zellzyklus kontrollieren. Die Störung dieser beiden Vorgänge ist häufig die Ursache für das unkontrollierte Wachstum von Krebszellen.
Dr. Bettina Kempkes: „EBNA-3A-negative B-Zelllinien werden in Zukunft ein wichtiges Zellkultursystem darstellen. Damit können wir untersuchen, ob sich das vielversprechende Protein EBNA-3A als Zielmolekül für die Therapie EBV-assoziierter Erkrankungen eignet.“
Origninalveröffentlichungen: Hertle, M.L. et al.; "Differential gene expression patterns of EBV infected EBNA-3A positive and negative human B lymphocytes"; PLoS Pathog 2009, 5, e1000506
Delecluse, H.J. et al.; "Propagation and recovery of intact, infectious Epstein-Barr virus from prokaryotic to human cells"; Proc Natl Acad Sci U S A 1998, 95, 8245-8250
Meistgelesene News
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
MEPACT von IDM Pharma in Europa für die Behandlung des nicht metastasierten, operablen Osteosarkoms zugelassen - Seit über 20 Jahren erste Zulassung eines neuen Wirkstoffs für die Behandlung des Osteosarkoms
Mikrobe des Jahres 2023: Bacillus subtilis – für Gesundheit und Technik - Schon jetzt ist Bacillus subtilis in vielen Industriezweigen unverzichtbar, und viele weitere Innovationen sind zu erwarten
Bakterielle Geräusche durch Graphenmembran enthüllt - Haben Sie sich jemals gefragt, ob Bakterien charakteristische Töne von sich geben?

Netzhaut weist auf Schweregrad der Schizophrenie hin - Studie könnte Basis für individuelle Prognosen liefern

Wie fehlerhafte mRNA erkannt und zerstört wird - Aufgabenverteilung neu definiert: Zwei sich ähnelnde Proteine können beim Qualitäts-Kontroll-Mechanismus von fehlerhafter mRNA füreinander einspringen

Neuer 'Chiraler Vortex' des Lichts enthüllt molekulare Spiegelbilder - Die völlig neue Lichtstruktur könnte es Arzneimittelentwicklern ermöglichen, ihre Arbeit klarer zu sehen als je zuvor

Fisch und Meeresfrüchte – verbesserter Spurennachweis möglicher Allergiequellen - „AQUALLERG-ID“: Forscher entwickeln Methoden zum Nachweis potentieller Lebensmittelallergene
Anterograde_Amnesie
Fatale Fehler in der Meldekette - Tagung erörtert Wege und Störungen der molekularen Signalübertragung in der Zelle

Was Melanome gegen Krebstherapie resistent macht - Erkenntnisse könnten den Weg für wirksamere Therapien ebnen