Mikro-Shuttles und Laser-Fernbedienung
Jacobs University entwickelt neue Methode zur Stoffwechselforschung in lebenden Zellen
Dem Zellbiologen Sebastian Springer und dem Biophysiker Matthias Winterhalter von der Jacobs University gelang es erstmals, zusammen mit Wissenschaftlern des Max-Planck-Instituts für Kolloid- und Grenzflächenforschung und weiteren englischen Kollegen, stoffwechselresistente Mikrokapseln in lebende Zellen einzuschleusen und deren Inhalt durch Laserimpuls mit exakter zeitlicher Kontrolle freizusetzen. Mit der in der aktuellen Online-Ausgabe von Small publizierten Methode dokumentierten die Forscher erstmals intrazelluläre Immunprozesse in hoher Zeitauflösung, vom Freisetzen zellfremder Proteine im Zellinneren bis zu deren Einbau als Antigene an der Zelloberfläche.
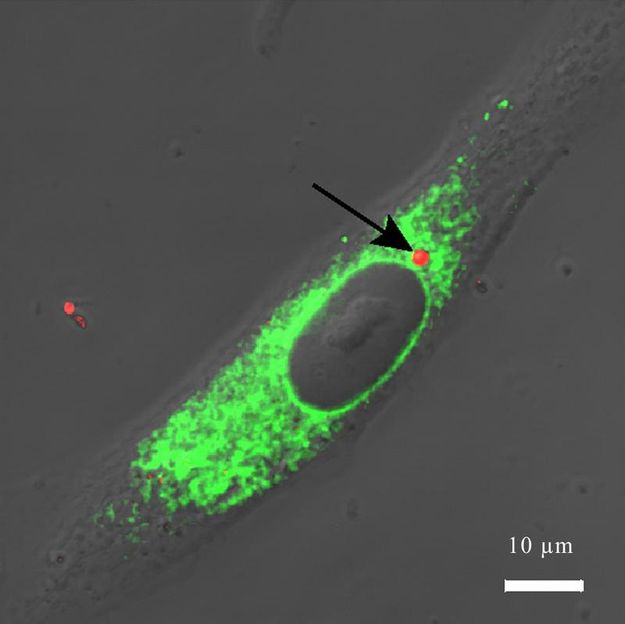
Kleiner als ein Zellkern (graues Oval, Mitte): das neue Substanz-Mikroshuttle (rot mit Pfeil) direkt "vor Ort" im Inneren einer lebenden Zelle (grün: Endoplasmatisches Reticulum).
Jacobs University Bremen
Unverzichtbar für das Verständnis von Stoffwechselprozessen in Zellen, beispielsweise ihre Immunantwort auf Virus-Infektionen, ist das zeitgenaue Nachvollziehen einzelner Transport- und Umsetzungsschritte der beteiligten Substanzen. Um die Kinetik solcher Prozesse zu beobachten, werden Markermoleküle verwendet, deren Schicksal in den Zellen mit den unterschiedlichsten Nachweismethoden verfolgt wird. Viele dieser Methoden haben jedoch den Nachteil, dass die molekularen Marker nicht in ausreichender Menge in die lebenden Zellen eingeschleust werden können. Andere Präparationsmethoden, bei denen entsprechend höhere Konzentrationen in die Zellen gelangen, beeinträchtigen die Zellfunktionen und somit auch den Ablauf der untersuchten Prozesse.
Ziel der Jacobs- und Max-Planck-Forscher war es, lebende Zellen möglichst schonend mit definierten Mengen experimenteller Marker zu präparieren und diese dann kontrolliert zu einem definierten Zeitpunkt im Zellinneren freizusetzen, nachdem sich die Zellen von negativen Präparationseffekten erholt haben. Für die Substanz-Einschleusung entwickelten die Forscher "Miniaturshuttles" aus speziellen stoffwechselresistenten Kunststofffasern mit eingelagerten Nano-Goldpartikeln und einem Durchmesser von rund zwei Mikrometern, was der Größe eines kleinen Bakteriums entspricht. Hergestellt werden die Kapseln, indem die Kunststofffasern netzartig um einen mineralischen Kern gewickelt werden, der dann durch Säure herausgelöst wird. Die so entstandenen porösen Mikro-Holkugeln können die gelöste Testsubstanz aufsaugen und werden dann versiegelt, indem die Kunststofffasern durch Erwärmen geschrumpft und die Poren so verschlossen werden.
In die lebendigen Zellen gelangen die gefüllten Kapseln mittels Diffusion durch die Zellwände, die vorher durch Elektroporation, eine Art Elektroschockbehandlung, für Partikel dieser Größe durchlässig gemacht wurden. Um die Testsubstanz im Zellinneren freizusetzen, werden die Zellen dann mit einem Infrarotlaser beschossen, der die Zellen nicht schädigt, jedoch die Nano-Goldpartikel in den Kapselwänden in Resonanzschwingung versetzt, so dass sie sich erhitzen und die Kapselwände aufschmelzen.
Zur Validierung der Methode schleusten die Wissenschaftler Mikrokapseln mit künstlichen, Fluoreszenz-markierten Proteinfragmenten in das Innere von flüssig kultivierten, lebenden Nagetierzellen ein, um kontrolliert eine Immunantwort der Zellen, die sogenannte Antigenpräsentation an der Zelloberfläche, auszulösen. Nach dem Freisetzen der Marker durch Laserimpuls konnten die Forscher die Ausbreitung der zellfremden Peptidmarker in der Zelle, ihre Aufnahme durch Protein-Komponenten des Immunsystems, den sogenannten MHC-Proteinen, und ihren Transport an die Zelloberfläche sowie ihren Einbau als Antigene in hoher zeitlicher Auflösung unter dem Fluoreszenzmikroskop beobachten.
"Die Mikrokapsel-Methode eröffnet uns völlig neue, aufregende Perspektiven, lebenden Zellen direkt bei ihrer Arbeit "über die Schulter zu schauen" und auch experimentell in intrazelluläre Vorgänge einzugreifen, ohne dass wir unsere Versuchsobjekte dabei zu sehr stören", kommentiert Sebastian Springer, Professor of Biochemistry and Cell Biology an der Jacobs University, den neuen Forschungsansatz. "Mit Hilfe der Mikroshuttles können wir beispielsweise versuchen, das Verhalten von Zellen gezielt zu manipulieren, indem wir zellfremde funktionelle Proteine oder auch zellfremde Erbinformation einschleusen, um auf vergleichsweise einfachem Weg eine genetische Umprogrammierung zu erreichen." Denkbar seien auch zukünftige medizinische Anwendungen, wie der direkte Transport von Medikamenten in das Innere von Tumor- oder anderen geschädigten Zellen, so Springer weiter.
Matthias Winterhalter, Jacobs-Professor of Biophysics, sieht darüber hinaus auch methodisches Potenzial, Stoffe nicht nur schonend in Zellen hinein zu transportieren, sondern auch gezielt in winzigsten Mengen zu extrahieren: "Wenn wir magnetische Nanoparikel in die Kapselwände einbauen, können wir die Shuttles als Miniaturprobengefäße in die Zellen schicken, sie dann in den Zellen verschließen und über einen Magneten zurückholen, um ihren Inhalt analysieren. Auf diese Weise kann man die Eigenschaften und Inhaltsstoffe einer einzigen Zelle untersuchen, was in dieser Präzision bisher praktisch unmöglich war. Dies ist besonders wichtig, wenn nur geringste Probenmengen zu Verfügung stehen, wie beispielsweise in manchen medizinischen Forschungszusammenhängen oder bei der Entwicklung von effizienten, automatischen Hochdurchsatzanalyseverfahren in der Industrie. Wir arbeiten bereits an einer automatisierten Lösung für alle nötigen Arbeitsschritte", so Winterhalter.