Ein Schalter für die Müllabfuhr
Max-Planck-Forscher klären auf, wie eine gezielte Formänderung die Stabilität von Proteinen und Tumorsuppressoren beeinflusst
Dem Zellbiologen Stefan Jentsch und seinem Mitarbeiter Dirk Siepe vom Max-Planck-Institut für Biochemie in Martinsried/München ist es gelungen, die Arbeitsweise des "Pin1 Schalters" zu entschlüsseln: Pin1 entscheidet wie viele Ubiquitin-Moleküle an Pin1-Zielproteine angeheftet werden, indem es die Konformität des Zielproteins in "cis" oder "trans" abändert. Ist Pin1 in der Zelle aktiv, so werden Pin1-Zielproteine nur mit einem oder wenigen Ubiquitinen markiert; ist Pin1 jedoch inaktiv, so werden viele Ubiquitin-Proteine in der Form einer Ubiquitin-Ubiquitin-Kette angeknüft. Damit entscheidet Pin1 schalterartig über die Lebensdauer einzelner Proteine.
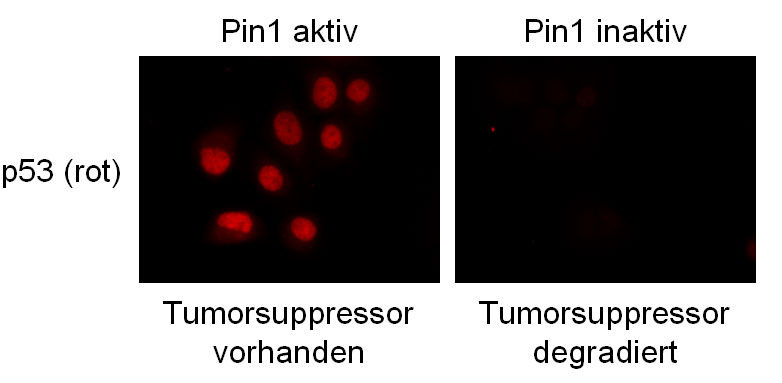
Pin1 reguliert die Stabiltät des Tumorsupressors: ist Pin1 aktiv, wird p53 stabilisiert und wirkt schützend vor proteasomalem Abbau (links), bei inaktivem Pin1 wird der Tumorsuppressor degradiert (rechts).
Siepe, Jentsch (MPI f. Biochemie)
Das Ubiquitin-Proteasom-System (UPS) ist in höheren Organismen für den Abbau von zellulären Proteinen verantwortlich. Überflüssige oder deformierte Proteine werden in diesem Abbauweg zunächst durch eine Markierung mit dem kleinen Protein Ubiquitin gekennzeichnet, bevor sie anschließend im Proteasom, dem "Protein-Schredder" der Zelle, abgebaut werden. Ausschlaggebend für den effizienten Abbau ist die Anzahl der angehängten Ubiquitin-Moleküle: werden viele Ubiquitin-Moleküle - häufig in Form einer Ubiquitin-Ubiquitin-Kette - angeheftet, so werden die so markierten Proteine dem Abbau zugeführt; werden jedoch nur ein oder wenige Ubiquitin-Moleküle angeknüpft, dann bleiben die Proteine der Zelle erhalten, sind aber in ihrer Funktion verändert. Fehler in diesem wichtigen Abbausystem können beim Menschen zu zahlreichen Krankheiten führen, u. A. zur Parkinson-Krankheit oder Krebs. In der neuesten Ausgabe von Nature Cell Biology berichten Dirk Siepe und Stefan Jentsch, dass Pin1, eine sogenannte cis/trans Prolyl-Isomerase, den Abbau von Proteinen, wie z.B. Tumorsuppressoren, reguliert.
Pin1 gehört zu einer Klasse von Proteinen, die aktiv die Faltung anderer Proteine beeinflussen können. Das Besondere an Pin1 ist, dass die Zielproteine wie bei einem Schalter in zwei Stellungen überführt werden können: "cis" und "trans" genannt. Dieser schalter-ähnliche Mechanismus wird in der Zell gezielt benutzt, um komplexe Prozesse zu steuern. Da Pin1 an Krankheitsbildern wie Alzheimer und Krebs beteiligt ist und auch direkt an das bekannte tumor-relevante Protein "p53" bindet, sind Forschungen zu Pin1 hochaktuell und versprechen neue therapeutische Ansätze. Der genaue Mechanismus, wie Pin1 in diesen Prozessen wirkt, war bisher aber weitgehend unklar.
Ausgehend von ihren Studien an dem Modellorganismus Hefe, bei der Pin1 lebensnotwendig ist, zeigte die Arbeitsgruppe vom Max-Planck-Institut auch, dass Pin1 von höchster Relevanz für die Tumorforschung ist. So fanden sie, dass bei hoher Pin1-Aktivität das Protein "p53", das die Entstehung von Tumoren bei Menschen unterdrückt ("Tumorsuppressor"), stabil ist und so schützend wirkt. Bei niedriger Pin1-Aktivität wird "p53" jedoch mit vielen Ubiquitin-Molekülen verknüpft und damit vom Proteasom abgebaut. Somit erscheint es denkbar, dass eine gezielte pharmakologische Aktivierung von Pin1 die Entstehung von Tumoren unterdrücken könnte.
Originalveröffentlichung: Dirk Siepe, Stefan Jentsch; "Prolyl isomerase Pin1 acts as a switch to control the degree of substrate ubiquitylation"; Nature Cell Biology 2009, 11: 967-972
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.