Ticket für die Reise durch die Zelle
Forscher entdecken Mechanismus für wesentliche Erkennungsvorgänge in lebenden Zellen
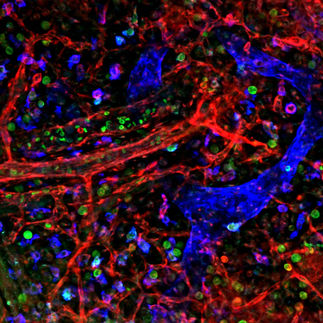
Eine lebende Zelle ist von einem dichten Geflecht von Polymerfasern durchzogen, die unter anderem dafür zuständig sind, verschiedene Zellbestandteile an ihre Bestimmungsorte in der Zelle zu ziehen: sie trennen bei der Zellteilung die für die beiden neuen Zellen gedachten Chromosomen voneinander, oder transportieren Zellorganellen und Bläschen mit Substanzen an ihren Bestimmungsort. Ein Forschungsteam um Michel Steinmetz (Paul Scherrer Institut, Villigen, Schweiz) und Anna Akhmanova (Erasmus Medical Center, Rotterdam, Niederlande) hat nun einen Mechanismus aufgeklärt, der dazu beiträgt, dass die Enden der Polymerfasern Chromosomen, Zellorganellen und andere Zellbestandteile spezifisch erkennen und sich mit ihnen verbinden können. Zuständig dafür sind spezielle Proteine, die wie Greifer wirken - sie docken mit dem einen Ende an der Faser an, mit dem anderen halten sie das spezifisch erkannte Zellbestandteil. Dabei sind die verschiedenen Greiferproteine sehr unterschiedlich und kompliziert aufgebaut - und haben doch alle gemeinsam, dass sie sich mit dem Faser-Ende verbinden können. Die Forscher konnten nun zeigen, dass es einen sehr kleinen Abschnitt gibt, der all diesen Proteinen gemeinsam ist und ihnen erlaubt sich an das Faser-Ende einzuhaken. Dieser Abschnitt funktioniert wie eine Fahrkarte - wer ihn hat, kann auf dem Faser-Ende mitfahren. Da solche Erkennungsprozesse an fast allen Vorgängen in der Zelle beteiligt sind, kann ihr detailliertes Verständnis helfen, neue Krebsmedikamente zu entwickeln, die in Krebszellen genau in diese Vorgänge eingreifen und so das Zellwachstum hemmen würden.
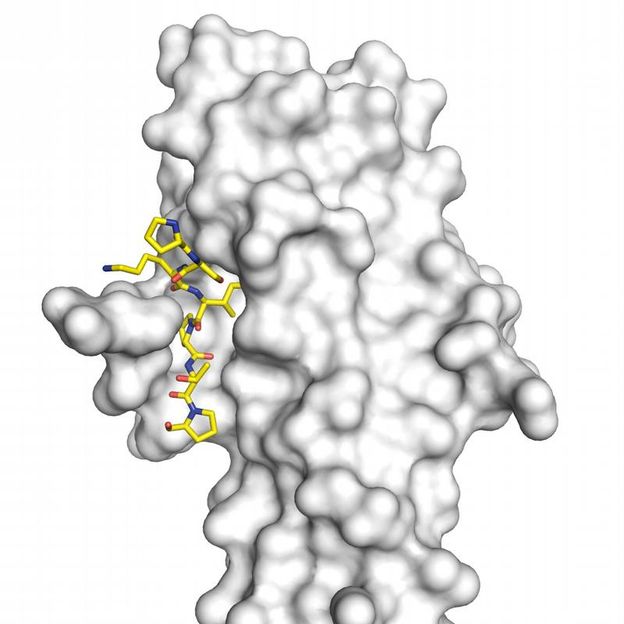
Über die Aminosäurefolge SxIP (farbig) können Proteine genau an das Protein EB1 und damit an die Enden der Mikrotubuli andocken.
PSI / Srinivas Honnappa et al., Cell, July 24, 2009
Bewegliches Zellskelett
Drei Arten von Polymerfasern durchziehen die lebende Zelle und bilden gemeinsam das Zellskelett, zu dessen Aufgaben es gehört, die Zelle zu stabilisieren und in Form zu halten. Sie bilden aber kein steifes Gerüst, sondern reagieren flexibel auf äussere Einflüsse und sind aktiv an zahlreichen lebenswichtigen Vorgängen in der Zelle beteiligt. Eine Art von Polymerfasern sind die Mikrotubuli - Röhrchen mit einem Durchmesser von ca. 25 Nanometern.
Diese Mikrotubuliröhrchen können wachsen, indem sie "Bausteine" aus der Zellflüssigkeit aufnehmen und an ihrem Ende anbauen oder schrumpfen, indem sie sich am Ende auftrennen und ihre "Bausteine" an die Umgebung abgeben. So kann das Ende eines solchen Mikrotubulus in Bewegung bleiben und am Aufbau des Zellskelettes teilhaben. Dabei sind auch stets Proteine beteiligt, die sehr unterschiedlich aufgebaut sein können und doch eine ganz spezifische Eigenschaft gemeinsam haben: sie können an die wachsenden Enden der Mikrotubuli binden.
Vier Aminosäuren
Ein besonders Mitglied dieser Klasse ist das Protein EB1, das als einziges direkt an die Enden der Mikrotubuli andocken kann. Alle anderen Proteine können sich lediglich mit dem EB1 verbinden. Dabei war lange unklar, wie EB1 und die anderen Proteine zueinanderfinden. Diese Frage beantworten jetzt die Ergebnisse der Forscher von Paul Scherrer Institut und Erasmus Medical Center. Sie konnten zeigen, dass allen diesen Proteinen eine bestimmte Abfolge - Sequenz - von vier Aminosäuren gemeinsam ist. Diese Sequenz hat dabei eine typische Form, die exakt in einen Freiraum in der Struktur des EB1 passt. So können die Proteine unabhängig von ihrer übrigen Form exakt an das EB1 und somit indirekt an die Enden der Mikrotubuli andocken. In der üblichen Nomenklatur wird diese Sequenz mit SxIP abgekürzt, wobei S für die Aminosäure Serin, I für Isoleucin und P für Prolin steht; x steht für eine beliebige andere Aminosäure.
Neue Medikamente möglich
"Dadurch dass Mikrotubuli an fast allen Vorgängen in der Zelle beteiligt sind - bis hin zur Trennung der Chromosomen während der Zellteilung - sind sie auch ein zentraler Angriffspunkt für Medikamente, die das Wachstum von Krebszellen aufhalten. Unsere Ergebnisse können somit helfen, neue Medikamente zu entwickeln, die gezielt in die von Mikrotubuli bestimmten zelluläre Prozesse eingreifen." erklärt Michel Steinmetz, Leiter der Arbeitsgruppe Proteinwechselwirkungen am Paul Scherrer Institut und Initiator des Projekts eine mögliche Anwendung seiner Resultate.
Die Forschungs-Ergebnisse wurden erst durch eine Kombination von Methoden möglich - so wurde die dreidimensionale Struktur der beteiligten Proteine untersucht und deren Aminosäuresequenzen nach gemeinsamen Abschnitten abgesucht. Schließlich konnte deutlich gezeigt werden, dass die Proteine nicht mehr über EB1 an die Mikrotubuli-Enden binden können sobald die SxIP-Sequenz beschädigt ist. Am Paul Scherrer Institut ist das Gesamtkonzept des Forschungsprojekts entwickelt und sind die strukturellen Untersuchungen mittels Röntgenkristallographie an der Synchrotron Lichtquelle Schweiz SLS des Paul Scherrer Instituts durchgeführt worden.
Neben Forschern des Paul Scherrer Instituts und des Erasmus Medical Centers waren noch Wissenschaftler des Instituts für Molekulare Biologie der ETH Zürich und des Biochemischen Instituts der Universität Zürich an der Arbeit beteiligt.
Originalveröffentlichung: Srinivas Honnappa et al.; "An EB1-Binding Motif Acts as a Microtubule Tip Localization Signal"; Cell 138, 366-376, July 24, 2009