Patrones complejos: construir un puente de lo grande a lo pequeño
Una nueva teoría permite simular la formación de patrones complejos en sistemas biológicos a través de diferentes escalas espaciales y temporales
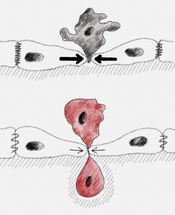
Para muchos procesos importantes para la vida, como la división celular, la migración de las células y el desarrollo de los órganos, es esencial la formación espacial y temporalmente correcta de patrones biológicos. Para entender estos procesos, la tarea principal no consiste en explicar cómo se forman los patrones a partir de una condición inicial homogénea, sino en explicar cómo los patrones simples se transforman en otros cada vez más complejos. Iluminar los mecanismos de esta compleja autoorganización a diversas escalas espaciales y temporales es un reto clave para la ciencia. Las técnicas denominadas "de grano grueso" permiten simplificar estos sistemas multiescalares, de modo que puedan describirse con un modelo reducido a grandes escalas de longitud y tiempo. "Sin embargo, el precio que se paga por el modelado grueso es que se pierde información importante sobre los patrones a pequeña escala, como el tipo de patrón. Pero la cuestión es que estos patrones desempeñan un papel decisivo en los sistemas biológicos. Por ejemplo, controlan importantes procesos celulares", explica Laeschkir Würthner, miembro del equipo dirigido por el físico de la LMU Erwin Frey y autor principal de un nuevo estudio que supera este problema. En colaboración con el grupo de investigación del profesor Cees Dekker (TU Delft), el equipo de Frey ha desarrollado un nuevo enfoque de grano grueso para los denominados sistemas de reacción-difusión con conservación de masa, en el que el análisis a gran escala de las densidades totales de las partículas implicadas permite predecir patrones a pequeña escala.

Prof. Erwin Frey
LMU / v.zingn
Cálculos numéricos en minutos en lugar de meses
Los científicos ilustraron el potencial de su enfoque con el sistema de la proteína Min, un modelo paradigmático para la formación de patrones biológicos. La bacteria E. coli utiliza varias proteínas Min que circulan por la célula para determinar en qué lugar tiene lugar la división celular. Un factor decisivo en este caso es que las proteínas implicadas se presentan con distinta frecuencia en función de su ubicación en la célula y su estado químico, es decir, tienen distintas densidades. "Ahora hemos conseguido reducir la complejidad de este sistema desarrollando una teoría que se basa únicamente en las densidades totales de las proteínas, de manera que podemos reflejar completamente la dinámica de la formación de patrones", dice Frey. "Esto supone una enorme reducción. Los cálculos numéricos se realizan ahora en cuestión de minutos en lugar de meses".
Los investigadores pudieron confirmar experimentalmente las predicciones teóricas del modelo, según las cuales la distribución de las proteínas depende de la geometría del entorno. Lo hicieron reconstruyendo el sistema de proteínas Min en una celda de flujo in vitro, y los resultados mostraron los mismos patrones de proteínas que se revelaron en la simulación. "Esta reconstrucción de la información a una escala de longitud pequeña a partir de una dinámica reducida a nivel macroscópico abre nuevas vías para una mejor comprensión de los sistemas multiescala complejos, que se dan en una amplia gama de sistemas físicos", afirma Frey.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.