Los investigadores desarrollan trampas moleculares para atacar el SARS-CoV-2
El esfuerzo conjunto de los científicos de la UC Riverside y la UCLA pretende impedir que el virus COVID-19 ataque a las células inmunitarias
Anuncios
Un equipo de investigación dirigido por científicos de la Universidad de California en Riverside y de la Universidad de California en Los Ángeles (UCLA) ha diseñado nuevas nanopartículas que sirven de "trampas moleculares" para atacar el SARS-CoV-2, el virus que propaga el Covid-19. Las trampas se unen al SARS-CoV-2 y le impiden atacar a los macrófagos, los glóbulos blancos que rodean y eliminan los microorganismos.
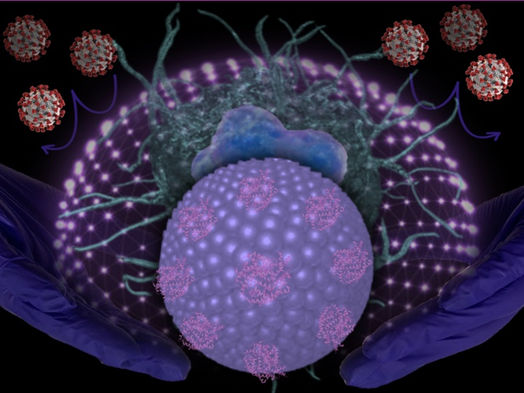
La imagen muestra las nuevas nanopartículas lipídicas dirigidas al SARS-CoV-2.
Sandro Satta, UCLA
"Estas nanopartículas pueden ayudar a mantener la función habitual de los glóbulos blancos para combatir la infección por virus", afirma Changcheng Zhou, profesor de ciencias biomédicas de la Facultad de Medicina de la UCR, que ha dirigido la investigación junto con Tzung K. Hsiai, profesor de medicina y bioingeniería de la UCLA.
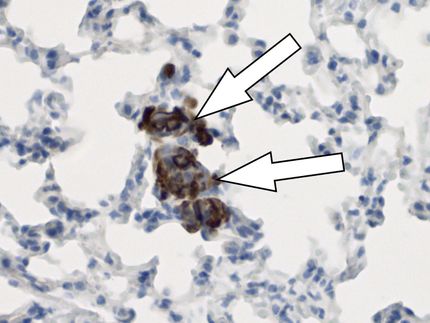
Macrófagos
Zhou explicó que los macrófagos actúan como células inmunitarias de primera línea en respuesta a la infección por el SARS-CoV-2, reconociendo y tragando los virus. Estas células también producen citoquinas, cuya producción es una parte importante de la respuesta inmunitaria del organismo, pero que puede quedar fuera de control. La tormenta de citoquinas inducida por el virus -la inundación del torrente sanguíneo por parte del sistema inmunitario con proteínas inflamatorias llamadas citoquinas- que sigue a una infección puede matar tejidos y dañar órganos. Zhou dijo que los macrófagos inflamados son capaces de infiltrarse en diferentes tejidos para causar efectos adversos asociados a la COVID-19, como la miocarditis o la inflamación del corazón.
"Nuestros hallazgos pueden utilizarse potencialmente para tratar las enfermedades asociadas a la COVID-19, incluidas las cardiopatías", dijo. "Además de la inflamación o las lesiones pulmonares, aproximadamente el 15% de los pacientes con COVID-19 con afecciones preexistentes pueden desarrollar arritmia cardíaca aguda y miocarditis, y los macrófagos pueden desempeñar un papel importante en este proceso".
Los mecanismos que subyacen a las disfunciones de los macrófagos mediadas por el SARS-CoV-2 no son del todo conocidos por los científicos. Según Zhou, esto se debe a que muchas células inmunitarias, incluidos los macrófagos, expresan niveles bajos de ACE2 humano, o hACE2, el receptor del SARS-CoV-2.
"Los estudios anteriores en esta línea de trabajo se han centrado principalmente en los mecanismos dependientes de hACE2", dijo. "Nuestros resultados, en cambio, sugieren que el SARS-CoV-2 puede secuestrar macrófagos e inducir respuestas inflamatorias incluso sin hACE2".
Trampas moleculares
Zhou y su equipo exploraron la posibilidad de neutralizar el SARS-CoV-2 con partículas de liposomas -moléculas que pueden utilizarse para transportar fármacos u otras sustancias a los tejidos- como estrategia terapéutica innovadora para tratar las enfermedades asociadas al COVID-19. El equipo utilizó nanopartículas para diseñar el "Liposoma-hACE2" y utilizarlo como señuelo.
"El virus del SARS-CoV-2 se une a hACE2 en la superficie de los liposomas en lugar de a las células inmunitarias, lo que impide que provoque una inflamación mediada por macrófagos", explicó Zhou. "También es posible que el liposoma-hACE2, con o sin unión al SARS-CoV-2, pueda ser internalizado por los macrófagos, lo que puede inhibir la replicación de las partículas virales del SARS-CoV-2. Esto contribuye a disminuir las respuestas inflamatorias".
Los análisis se realizaron en macrófagos de humanos y ratones. En el tejido murino, los investigadores descubrieron que las trampas moleculares inhibían la infiltración de macrófagos inducida por la proteína Spike del SARS-CoV-2 en el pulmón y el corazón, suprimiendo así la inflamación pulmonar y cardíaca. El equipo también descubrió que la proteína Spike estimulaba la inflamación mediante la activación de una vía de señalización denominada NF-κB.
"Las nanopartículas que desarrollamos son muy eficaces contra la inflamación inducida por el virus", dijo Zhou. "La supresión de la IκB quinasa β, un regulador clave de la señalización NF-κB, puede abolir las respuestas inflamatorias de los macrófagos inducidas por la proteína Spike". La quinasa IκB β es, por tanto, esencial para la inflamación de los macrófagos inducida por el virus. Podría ser una importante diana para combatir el virus del SARS-CoV-2".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.