Microscopía fría: Hacer visible lo invisible
El enfriamiento ultrarrápido permite observar los patrones moleculares de la vida
La microscopía de luz fluorescente tiene la capacidad única de observar los procesos celulares en una escala que abarca cuatro órdenes de magnitud. Sin embargo, su aplicación a las células vivas está fundamentalmente limitada por el movimiento muy rápido e incesante de las moléculas y la destrucción de las sondas fluorescentes inducida por la luz. La criopreservación ultrarrápida de las células durante la observación en vivo en un microscopio, desarrollada por el grupo del profesor Philippe Bastiaens en el Instituto Max Planck de Fisiología Molecular de Dortmund, sortea ahora estos problemas fundamentales y permite observar patrones moleculares de la vida que de otro modo serían invisibles.
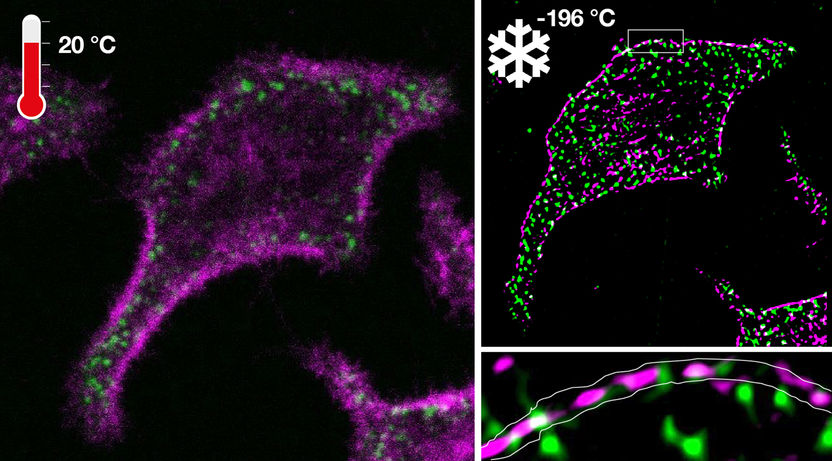
Microscopía de fluorescencia de una oncoproteína y su correspondiente supresor de tumores en una célula viva antes de la criopreservación (izquierda) e imagen de superresolución obtenida bajo criopreservación (derecha).
MPI of Molecular Physiology
Los casi 100 billones de células de nuestro cuerpo están vivas porque se mantienen en un estado permanentemente activo mediante el consumo continuo de energía. Los patrones microscópicos que constituyen una célula se originan, por tanto, en el comportamiento siempre dinámico de miles de millones de biomoléculas de tamaño nanométrico, como proteínas, lípidos, ácidos nucleicos y otras moléculas, que bullen de forma aparentemente desorganizada. Para observar cómo surge una organización a mayor escala de esta actividad incesante, las especies biomoleculares pueden equiparse selectivamente con sondas fluorescentes. Estas moléculas fluorescentes son catalizadores de fotones: absorben fotones de alta energía (por ejemplo, luz azul) y posteriormente emiten fotones de menor energía (desplazados al rojo). Estos fotones pueden visualizarse a través de un microscopio, no sólo para localizar con precisión las biomoléculas marcadas, sino también para informar sobre las reacciones moleculares locales. Sin embargo, la destrucción de las sondas inducida por la luz y el desenfoque por el propio movimiento molecular vital son dos problemas fundamentales que dificultan la observación de cómo los procesos moleculares de la vida generan estructura a escala celular.
Un principio de incertidumbre para la microscopía de fluorescencia
El grado de resolución de una determinada estructura o molécula mediante la microscopía de fluorescencia depende fundamentalmente de la cantidad de luz que se pueda recoger de esta estructura. Esto es análogo a intentar ver las estrellas en el cielo nocturno. Sólo las estrellas que son claramente más brillantes que su entorno son visibles a primera vista. Si fotografiamos el cielo nocturno con un tiempo de exposición largo, se hacen visibles más estrellas que, sin embargo, se difuminan por la rotación de la Tierra. Del mismo modo, en la microscopía de fluorescencia se puede prolongar el tiempo de exposición para aumentar la cantidad de luz detectada. Sin embargo, las estructuras microscópicas nunca permanecen inmóviles, sino que presentan un movimiento tanto aleatorio como dirigido. Prolongar el tiempo de exposición conduce a la difuminación de las estructuras. En este caso, sin embargo, el movimiento de las pequeñas estructuras es mucho más rápido que la catálisis de los fotones por el fluoróforo y, por tanto, la precisión no puede mejorarse creando mejores detectores o una iluminación más potente. Además, el proceso de catálisis de fotones produce radicales tóxicos, que no sólo destruyen los procesos moleculares y acaban matando a las células, sino que también destruyen la propia molécula fluorescente. En última instancia, esto limita la cantidad de luz que se puede recoger de las sondas en las células vivas.
La solución es literalmente genial
Jan Huebinger, del grupo de Philippe Bastiaens, ha desarrollado ahora una tecnología para detener los patrones de actividad molecular durante la observación de su dinámica en las células vivas en cualquier punto de tiempo de interés en milisegundos directamente en el microscopio de fluorescencia. De este modo, se pueden evitar al mismo tiempo los problemas fundamentales del desenfoque del movimiento y la fotodestrucción.
La detención se realiza mediante un enfriamiento extremadamente rápido a temperaturas tan frías (-196°C), que el movimiento molecular queda prácticamente detenido. La detención tiene que ser muy rápida por dos razones. En primer lugar, los patrones microscópicos energizados que definen a las células vivas se desintegran en el estado muerto si la detención es demasiado lenta. En segundo lugar, la velocidad de la detención tenía que ser más rápida que el proceso de formación de hielo, que destruiría las células. Esto también puede observarse a mayor escala, cuando, por ejemplo, los tomates se vuelven muy blandos tras la congelación. La formación de hielo es extremadamente rápida en el rango crítico entre 0 °C y -136 °C. Sin embargo, de forma no intuitiva, a temperaturas muy bajas (por debajo de -136 °C) ya no se pueden formar cristales de hielo, porque el movimiento de las moléculas de agua también está prácticamente detenido. Esto significa, literalmente, que el enfriamiento tenía que ser más rápido que 100.000 °C por segundo. Los investigadores han superado este reto técnico desarrollando un dispositivo de enfriamiento ultrarrápido integrado en un microscopio en el que el frío del nitrógeno líquido (-196°C) se acelera a alta presión sobre un diamante. El mismo diamante sostiene también la muestra que contiene las células en su lado opuesto. El estallido de alta presión en combinación con la excepcional conductancia térmica del diamante permitió alcanzar las altas tasas de enfriamiento necesarias para detener las células a -196°C en su configuración nativa. Esto no sólo resolvió el problema del desenfoque de la motilidad, sino que también detuvo la destrucción fotoquímica. Esto abre la posibilidad de una exposición prácticamente infinita, resaltando patrones moleculares que de otro modo quedarían ocultos en el ruido.
Hacer visible lo invisible
La criodetección ultrarrápida permitió utilizar potencias de láser normalmente destructivas para analizar patrones moleculares nativos con resoluciones de decenas de nanómetros que de otro modo serían invisibles. Es más, debido a la ausencia de fotodestrucción a -196 °C, las mismas células detenidas podían observarse mediante diferentes modalidades de microscopía para medir patrones desde la escala molecular hasta la celular. Esta nueva tecnología permitió descubrir la coorganización nanoscópica de una oncoproteína y una proteína supresora de tumores que evita que las células presenten un comportamiento maligno. "Se trata de un paso habilitador para la microscopía de fluorescencia, especialmente la combinación de la microscopía de superresolución y la microespectroscopía que permite el mapeo de las reacciones moleculares en las células a múltiples escalas. Cambiará la forma de observar la organización molecular y los patrones de reacción en las células y, por tanto, proporcionará más información sobre las capacidades de autoorganización de la materia viva", afirma Philippe Bastiaens.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.




































