Las redes moleculares sirven como planos celulares
Las redes están en el corazón de todo, desde los sistemas de comunicación hasta las pandemias. Ahora los investigadores han encontrado que un tipo único de red también subyace en las estructuras de los compartimentos celulares críticos conocidos como organelos sin membrana. Estos hallazgos pueden proporcionar conocimientos clave sobre el papel de estas estructuras tanto en la enfermedad como en las operaciones celulares.
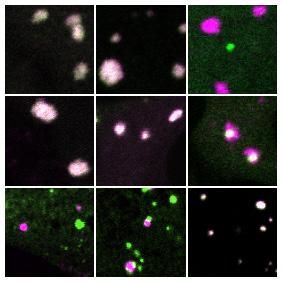
Los investigadores han descubierto que tipos únicos de redes subyacen en las estructuras de los orgánulos sin membrana, como los gránulos de estrés y los cuerpos de procesamiento. Imagen de los investigadores.
The researchers
"Antes de este estudio, conocíamos el principio físico básico por el cual se forman estos compartimentos ricos en proteínas - se condensan desde el citoplasma en gotitas líquidas como el rocío en una hoja de hierba", dijo David Sanders, un investigador postdoctoral en Ingeniería Química y Biológica en la Universidad de Princeton. "Pero a diferencia de las gotas de rocío, que están compuestas de un solo componente (el agua), las gotas celulares son intimidantemente complejas. Nuestro trabajo descubre principios sorprendentemente simples que creemos que son universales para el ensamblaje de orgánulos líquidos, y abre nuevas fronteras en el estudio de su papel en la salud y la enfermedad".
Sanders es el autor principal de un artículo en la revista Cell que describe un plan para el ensamblaje de estas estructuras líquidas, también llamadas condensados. Los investigadores observaron de cerca dos tipos de condensados, los gránulos de estrés y los cuerpos de procesamiento ("cuerpos P"). En el artículo de Cell, los investigadores dirigidos por Clifford Brangwynne, profesor de Ingeniería Química y Biológica en Princeton y el Instituto Médico Howard Hughes, combinaron la ingeniería genética y los enfoques de la microscopía de células vivas para revelar las reglas subyacentes al ensamblaje y la estructura de los gránulos de estrés, y por qué siguen siendo distintos de sus parientes cercanos, los cuerpos P.
Los gránulos de estrés se ganan su nombre al aparecer cuando las células son removidas de su zona de confort, por ejemplo, después del calor o la detección de químicos nocivos. Tanto los gránulos de estrés como los cuerpos P están ligados a un influjo de ARN, material genético que actúa como mensajero entre el código genético permanente (ADN) de la célula y sus principales caballos de batalla (proteína). Aunque la función de estos condensados no está clara, algunos científicos creen que ambos desempeñan un papel en la supervisión de las acciones celulares del mensajero del ARN. Independientemente de la función, los gránulos de estrés son secuestrados por infecciones virales y han sido implicados en enfermedades de envejecimiento. Comprender su ensamblaje es por lo tanto crítico para el desarrollo de nuevas terapias.
En las células sanas, máquinas celulares llamadas ribosomas se mueven continuamente a lo largo de la línea de ensamblaje del ARN, aislando el mensaje genético de su entorno y fabricando proteínas esenciales para la supervivencia de la célula. Sin embargo, cuando un estrés externo detiene la línea de ensamblaje, el ARN se desnuda y se agrupa en gránulos de estrés y cuerpos P. El equipo de Brangwynne desarrolló un enfoque para determinar cómo se produce esta aglomeración y por qué ciertos grupos prefieren asociarse, pero impiden que sus componentes se mezclen en una gota uniforme.
A partir de estudios anteriores realizados por coautores de la Universidad de Harvard, los investigadores sabían que una proteína llamada G3BP, que está específicamente dirigida a muchas infecciones virales, es necesaria para que se formen gránulos de estrés. Pero, ¿qué es lo que hace especial al G3BP? Para determinar esto, los investigadores utilizaron células editadas por genes que carecen de la proteína G3BP y son incapaces de formar gránulos de estrés después de la adición de un químico.
"Esto nos permitió añadir componentes, uno por uno, para ver qué era necesario para su formación", dijo Sanders. "El primer paso fue agregar el G3BP de nuevo con varias partes de la proteína que faltaban."
Este enfoque identificó dos partes de la proteína que eran esenciales: una parte que se une al ARN y otra que se une a proteínas específicas. Sorprendentemente, los investigadores pudieron realizar ingeniería inversa de este rescate molecular al unir partes similares de proteínas no relacionadas. El equipo demostró que los andamios de proteínas de gránulos de estrés requerían una colección específica de bloques de construcción, con un número necesario de conectores químicos que se agarraban a las hebras de ARN y las aglutinaban. Los conectores, llamados dominios de unión al ARN, se encuentran en muchos tipos de proteínas, pero vienen en diferentes sabores que especifican su función biológica.
"Fue notablemente simple reconstruir esto", dijo Sanders. "Todo lo que necesitabas era un andamio. Cualquier dominio de unión al ARN funcionaría siempre que hubiera suficientes."
Finalmente, los investigadores fueron capaces de formar condensados idénticos usando más de una docena de andamios diferentes. "Lo que realmente importaba era si había suficientes dominios de unión para contactar con el ARN y luego conectarlos juntos en el espacio", dijo Sanders. "Se han utilizado ideas similares para entender el ensamblaje de materiales no vivos, lo que inspiró nuestro pensamiento sobre el problema desde una perspectiva de red".
Los investigadores se dieron cuenta de que la formación de los condensados era en el fondo un problema de red. Cuando había suficientes dominios de unión disponibles para agarrar las hebras de ARN, los condensados se formaban rápidamente. A nivel celular, las concentraciones de proteínas con dominios de unión determinaron si los gránulos de estrés se producirían o no en cualquier punto de la célula.
Esta comprensión también proporcionó información sobre la conocida tendencia de los gránulos de estrés y los cuerpos P a unirse. Esta tendencia, que es objeto de una intensa investigación por parte de numerosos grupos de investigación, está relacionada con las redes internas de los gránulos de estrés y los cuerpos P, y la forma en que esas redes se intersectan.
"Sucede que el G3BP tiene la mayor abundancia y afinidad de red de las proteínas de gránulos de estrés", dijo Sanders. "Le gusta interactuar con otras proteínas que de forma similar se agarran al ARN. La razón por la que los gránulos de estrés y los cuerpos P se pegan entre sí es que se superponen en sus redes, formando un pegamento adhesivo. Lo interesante es que los dos líquidos tienen suficiente superposición de redes para adherirse, pero son tan diferentes que no se mezclan completamente. Si aumentas el grado de superposición de la red, puedes colapsar las gotas en un solo condensado. Además, si quitas el pegamento de la red solapada, se desprenden. Por lo tanto, describir los condensados como gránulos de tensión o cuerpos P es realmente una falsa dicotomía. Lo que importa es la conectividad de la red y esto estará determinado por los distintos estados celulares".
Brangwynne compartió su entusiasmo sobre el futuro trabajo de construcción a partir de estos estudios, determinando si el proyecto de los gránulos de estrés y los cuerpos P se aplica a otros condensados como los nucleolos. "Nuestro grupo había demostrado previamente que los nucleolos exhiben una estructura similar, como diferentes tipos de gotitas de aceite que no se mezclan, todas flotando dentro de una solución de agua. Pero no entendíamos las reglas moleculares. Usando el sistema de gránulos de estrés, podemos haber descubierto un marco general para entender este problema, que es emocionante de pensar en el contexto de diferentes áreas de la biología, y para explotarlo en aplicaciones biomédicas como la ingeniería de organelos y la terapéutica".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.