El equipo de investigación encuentra un posible nuevo enfoque para los medicamentos contra la enfermedad del sueño
El láser de rayos X revela la estructura de una enzima clave del parásito Trypanosoma brucei
Usando flashes de rayos X ultra brillantes, un equipo de investigadores ha localizado un objetivo potencial para nuevas drogas contra la enfermedad del sueño: Los científicos han descifrado la detallada estructura espacial de una enzima vital del patógeno, el parásito Trypanosoma brucei. El resultado proporciona un posible plano para una droga que bloquee específicamente esta enzima y así mate al parásito, como el equipo dirigido por Christian Betzel de la Universidad de Hamburgo, Lars Redecke de la Universidad de Lübeck y DESY y Henry Chapman de DESY informa en la revista Nature Communications.
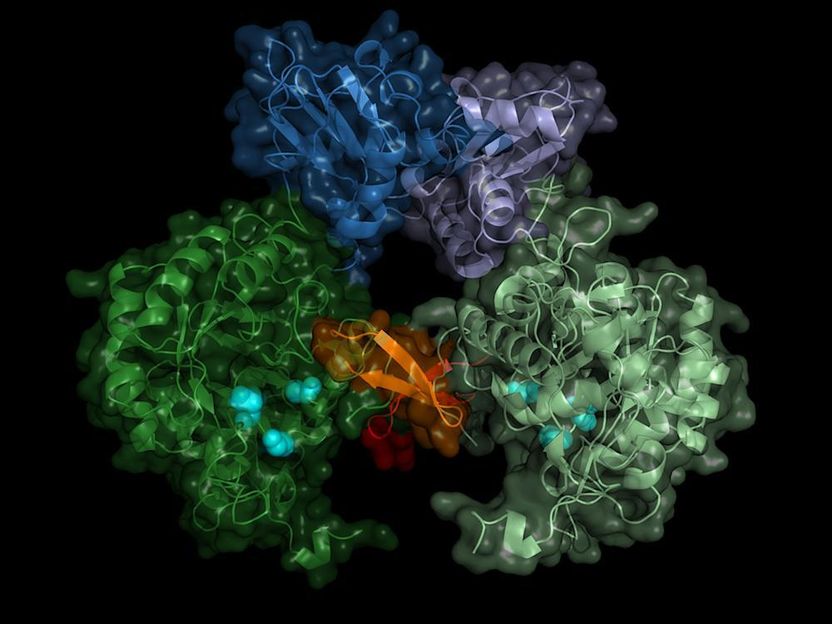
La estructura de la PIM del parásito es la deshidrogenasa. La enzima activa forma pares (dímeros), la región de "switch" (región de Bateman) se muestra en tonos de azul.
University of Lübeck/DESY, Lars Redecke
La enfermedad del sueño (tripanosomiasis africana) es una enfermedad tropical causada por el parásito Trypanosoma brucei, que se transmite por la picadura de la mosca tse-tsé, que habita en gran parte del África tropical. En el cuerpo, el parásito se multiplica primero bajo la piel, en la sangre y en el sistema linfático y luego migra al sistema nervioso central. Si no se trata, la enfermedad es casi siempre fatal. Gracias a las intensas medidas de control, el número de casos registrados ha disminuido drásticamente en los últimos años. No obstante, la enfermedad del sueño sigue siendo considerada una de las enfermedades tropicales más importantes. Según la Organización Mundial de la Salud, más de 60 millones de personas de las zonas rurales del África subsahariana están en peligro. La guerra, el desplazamiento y la migración pueden hacer que la enfermedad se agrave.
En la búsqueda de un posible punto de partida para las drogas contra el patógeno, los investigadores habían apuntado a una enzima central del organismo unicelular, la inosina-5'-monofosfato deshidrogenasa (IMPDH). "Esta enzima pertenece al inventario central de todo organismo y es un blanco interesante para las drogas porque regula la concentración de dos nucleótidos vitales en la célula: el difosfato de guanosina y el trifosfato de guanosina", dice Redecke. "La célula necesita estos nucleótidos para suministrar energía y construir estructuras más grandes como el genoma. Si se interrumpe este ciclo, la célula muere".
La enzima tiene una especie de interruptor de encendido/apagado que se activa al acoplar las propias moléculas de la célula. Un enfoque prometedor es bloquear este cambio con una molécula adaptada con precisión. Para construir tal inhibidor, debe conocerse la estructura espacial exacta del interruptor. Los biólogos estructurales pueden determinar la estructura de las biomoléculas usando rayos X. Para ello, primero cultivan pequeños cristales de las biomoléculas, que luego generan patrones de difracción característicos al ser iluminados con rayos X. A partir de estos patrones se puede calcular la estructura atómica del cristal y sus bloques de construcción, las biomoléculas.
Este enfoque se complica a menudo por la intratabilidad de la mayoría de las biomoléculas contra la formación de cristales. Y si tales cristales pueden crecer, suelen ser extremadamente sensibles a los rayos X de alta energía y se destruyen rápidamente. "Aunque ya se conocen las estructuras de numerosas deshidrogenasas IMP, no se había logrado cultivar cristales de la versión de la enzima Tripanosoma brucei", informa Betzel, que también es investigador del Grupo de Excelencia del CUI: Imágenes avanzadas de la materia en la Universidad de Hamburgo y DESY.
Por lo tanto, el equipo eligió una ruta alternativa: el grupo de co-autores Michael Duszenko de la Universidad de Tubinga indujo a ciertas células de insectos a cristalizar biomoléculas dentro de ellas. Usando esta llamada cristalización del celuloide, el mismo equipo ya había descifrado otra enzima clave del patógeno de la enfermedad del sueño, la catepsina B, que también es un objetivo potencial de la droga. Resultó que las células alteradas del insecto también producen cristales de la deshidrogenasa ahora investigada. Estos cristales forman diminutas agujas de alrededor de 5 milésimas de milímetro (5 micrometros) de grosor y hasta 70 micrometros de largo, de modo que sobresalen de las células productoras.
Los cristales in-celulares son tan pequeños que se requieren rayos X muy brillantes para analizarlos. Cuanto más grande es un cristal, más átomos dentro de él pueden dispersar los rayos X, causando un mejor patrón de difracción. Por lo tanto, los investigadores utilizaron el láser de rayos X LCLS en el Laboratorio Nacional de Aceleradores SLAC en los EE.UU. para el análisis. "Los láseres de rayos X generan destellos extremadamente intensos", explica Chapman, quien es un científico principal del DESY en el Centro de Ciencia de Láser de Electrones Libres CFEL y uno de los portavoces del Cluster de Excelencia CUI: Imágenes avanzadas de la materia. "Aunque los cristales sensibles se evaporan inmediatamente, primero generan un patrón de difracción del cual se puede obtener la estructura". El método utilizado aquí para explotar estas propiedades, llamado cristalografía de femtosegundo en serie, fue desarrollado anteriormente por muchos de los investigadores involucrados en este estudio y fue nombrado uno de los diez mejores avances del año por la revista Science en 2013.
El equipo registró los patrones de difracción de más de 22.000 microcristales y pudo calcular la estructura espacial de la enzima con una precisión de 0,28 millonésimas de milímetro (nanómetro), lo que corresponde aproximadamente al diámetro de un átomo de aluminio. "El resultado no sólo muestra la estructura exacta del interruptor de la enzima, la región de Bateman, sino también qué moléculas de la célula activan el interruptor y cómo estos llamados cofactores se unen al interruptor de la enzima", informa Karol Nass, que realizó este trabajo durante sus estudios de doctorado en el DESY. Actualmente trabaja en el Instituto Paul Scherrer de Suiza y es, junto con Redecke, uno de los principales autores de la publicación.
El interruptor funciona con las moléculas adenosina trifosfato (ATP) y guanosina monofosfato (GMP). "La ventaja de nuestro método no es sólo que podemos investigar la enzima a temperatura ambiente, a la que la enzima opera de forma natural, sino también que durante la cristalización del celuloide los cofactores naturales se unen a la enzima", dijo Betzel. Según el investigador, los datos podrían proporcionar ahora un enfoque para inhibir la deshidrogenasa IMP del parásito. "Se podría pensar en construir una especie de cierre que cubriera los sitios de unión de ambos cofactores, por ejemplo."
Sin embargo, un desafío pendiente es diseñar el inhibidor de la deshidrogenasa IMP de manera tan específica que bloquee la enzima del parásito, pero no la enzima humana. Si esto tiene éxito, el método podría extenderse potencialmente a otros patógenos, explica Betzel. "Otros parásitos tienen una estructura muy similar, y también podría ser posible atacarlos a través de la respectiva deshidrogenasa IMP. La enzima es un blanco muy interesante para las drogas, por ejemplo contra la tenia del zorro o el patógeno de la elefantiasis".
Las universidades de Hamburgo, Lübeck y Tubinga, la Academia Rusa de Ciencias, la Universidad Estatal de Arizona, el Laboratorio Nacional Lawrence Livermore de los EE.UU., el Instituto Max Planck de Investigación Médica, el Laboratorio Nacional de Aceleradores de los EE.UU. SLAC, la Universidad de Gotemburgo y DESY participaron en esta investigación.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.