Warum hungernde Zellen das Leben verlängern
Forscher decken die Rolle mitochondrialer Sirtuin-Proteine auf
Dass die stressbedingte Schädigung von Zellen eine wichtige Rolle bei Alterungsprozessen spielt, leuchtet ein. Erstaunlich ist aber, dass Nahrungsmangel, der selbst eine Form von Stress darstellt, Alterungsprozesse verlangsamt und die Lebensspanne von Organismen verlängert. Als mitverantwortlich für diese Mechanismen werden Proteine der Sirtuin-Familie angesehen. Die genauen Aufgaben ihrer sieben Mitglieder bei Säugetieren waren bislang allerdings ungeklärt. Erstes Licht bringen jetzt Studienergebnisse von Bochumer und Dortmunder Proteinforschern um Juniorprofessor Dr. Clemens Steegborn (Institut für Physiologische Chemie der RUB) in die Angelegenheit. Sie ermittelten erste Funktionen der beiden menschlichen Sirtuine Sirt3 und Sirt5, die sich in den Mitochondrien aufhalten.
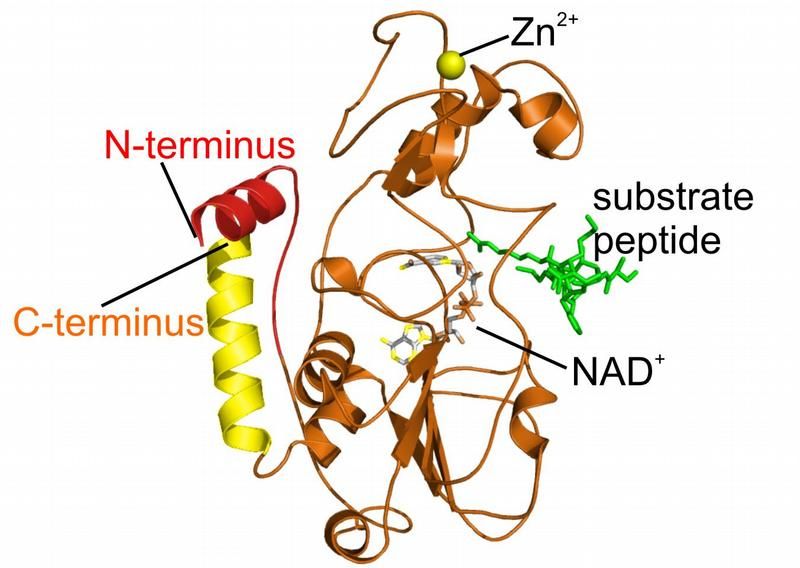
Sirtuin
Ruhr-Universität Bochum
Mitochondrien sind in der Zelle für die Bereitstellung von Energie durch Verwertung von Nahrungsmolekülen verantwortlich. Daher liegt es nahe, dass dort lokalisierte Sirtuine am lebensverlängerten Effekt von Nahrungsmangel mitwirken. Die Forscher fanden allerdings heraus, dass Sirt5 sich nicht nur im Innern der Mitochondrien befindet, sondern auch im so genannten Intermembranraum zwischen äußerer und innerer Membran der Mitochondrien. Dort kann es das Protein Cytochrom c modifizieren, das sowohl bei der Energiegewinnung als auch beim zellulären Selbstmordprogramm (Apoptose), der Reaktion auf extremen zellulären Stress, eine zentrale Rolle spielt. „Eine Störung der Apoptose könnte die vermutete Rolle von Sirt5 bei bestimmten Krebserkrankungen erklären“, erläutert Dr. Steegborn, „aber die genaue Funktion von Sirt5 und der Modifikation von Cytochrom c konnten noch nicht endgültig geklärt werden.“
Für Sirt3 fanden die Wissenschaftler dagegen eine klar definierte Funktion. Sie konnten zeigen, dass Sirt3 zwei zentrale Stoffwechselenzyme verändert und sie dadurch aktiviert. Diese Aktivierung ermöglicht es der Zelle, bei Mangel an herkömmlichen Nährstoffen andere Energiequellen zu verwenden und diese effizient zu nutzen. Sirt3 aktiviert dabei spezielle Formen dieser Enzyme, die gleichzeitig NADPH bilden, welches für die Regeneration zellulärer Anti-Stress-Systeme benötigt wird. Das erklärt, wie die bei Nahrungsmangel erhöhte Sirt3-Aktivität zu einer verlängerten Lebensspanne beitragen kann.
Verschiedene Forschergruppen konnten in Modellorganismen zeigen, dass eine Erhöhung von Sirtuinaktivität deren Lebensspanne verlängern kann. Die Situation im Menschen ist allerdings komplexer, da hier sieben verschiedene Sirtuine an verschiedenen Orten in der Zelle und jeweils mit spezifischen Funktionen zu finden sind. Die aktuellen Arbeiten der Bochumer und Dortmunder Forscher sind ein erster Schritt zum Verständnis dieser Prozesse. Ein genaues Verständnis der spezifischen Funktionen ist Voraussetzung, um für eine gewünschte therapeutische Wirkung das richtige Sirtuin als Zielmoleküle zu verwenden. „Dadurch wird sich vermutlich kein lebensverlängerndes Elixir finden“, schätzt Dr. Steegborn, „aber wir hoffen, durch diese Arbeiten Wirkstoffe zu erhalten, mit denen altersbedingte Erkrankungen behandelt werden können und die somit ein ‚gesundes Altern’ ermöglichen.“
Originalveröffentlichung: Christine Schlicker et al.; "Substrates and regulation mechanisms for the human mitochondrial sirtuins Sirt3 and Sirt5"; J Mol Biol. Oct 10, 2008 vol. 382, no. 3, 790-801
Meistgelesene News
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.




















































