Warum Mäuse nicht wie Kaninchen hoppeln
Nervenzell-Netzwerke im Rückenmark steuern die Beinbewegungen beim Laufen
Anzeigen
Neurowissenschaftler des Max-Planck-Instituts für Experimentelle Medizin in Göttingen und des Max-Planck-Instituts für Neurobiologie in Martinsried haben die molekularen Grundlagen eines Entwicklungsprozesses entschlüsselt, der die Verschaltung von Nervenzellen im Rückenmark steuert und so die Beinbewegung beim Laufen koordiniert .
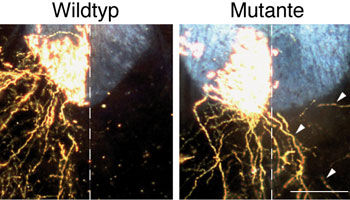
Nervenzellfortsätze im Rückenmark von genetisch veränderten Mäusen, die kein alpha-2-Chimaerin herstellen können (Mutante), überqueren die Mittellinie des Rückenmarks (Pfeilspitzen). Dies ist im Rückenmark von normalen Mäusen nicht der Fall (Wildtyp). Der Größenmaßstab (weißer Balken) zeigt 100 m an.
Max-Planck-Institut für Experimentelle Medizin
Kaninchen bewegen beim Laufen ihre Beine parallel. Und weil sie deshalb hoppeln, findet jedermann sie putzig. Mäuse dagegen laufen, indem sie sowohl ihre Vorderbeine als auch ihre Hinterbeine abwechselnd bewegen. Für die Laufbewegung der Extremitäten von Säugetieren sind Mustergeneratoren im Rückenmark verantwortlich - Gruppen von Nervenzellen, die die Beinmuskulatur steuern. Ob die Beine eines Tieres sich beim Laufen parallel oder abwechselnd bewegen, wird durch die Verschaltung der Nervenzellen in diesen Mustergeneratoren bestimmt. Die Göttinger Neurowissenschaftlerinnen Andrea Betz und Heike Wegmeyer vom Max-Planck-Institut für Experimentelle Medizin haben nun gemeinsam mit Rüdiger Klein und Joaquim Egea vom Max-Planck-Institut für Neurobiologie in Martinsried und Kollegen der Universität Uppsala in Schweden die Grundlagen eines Entwicklungsprozesses entschlüsselt, der die genaue Verknüpfung derjenigen Nervenzellen sicherstellt, die das Laufverhalten von Mäusen steuern.
Eine Barriere im Rückenmark
Die alternierenden Laufbewegungen von Mäusen und vielen anderen Tieren werden durch Nervenzellen eines zentralen Mustergenerators im Rückenmark kontrolliert. Diese Nervenzellen sind normalerweise so verschaltet, dass eine gleichzeitige paarweise Bewegung der beiden Vorder- oder Hinterbeine vermieden wird. Die entsprechende Verschaltung wird während der frühen Entwicklung des Nervensystems ausgebildet und durch molekulare Barrieren gesteuert, die es auswachsenden Fortsätzen von Nervenzellen verbieten, von einer Seite des Rückenmarks in die gegenüberliegende Seite einzuwachsen. Als Barriere an der Mittellinie des Rückenmarks fungieren dabei EphrinB3-Proteine, die sich nähernde Nervenzellfortsätze zum Rückzug zwingen, indem sie EphA4-Rezeptoren auf deren Oberfläche aktivieren. Die Aktivierung dieser Andockstellen auf den Nervenzellfortsätzen führt zu deren Kollaps - ein Effekt der durch den Zusammenbruch des Zellskeletts verursacht wird.
Bisher war unbekannt, wie EphA4-Rezeptoren das Barriere-Signal der EphrinB3-Proteine ins Zellinnere fortleiten und so den Zusammenbruch des Zellskeletts und den Kollaps von Nervenzellfortsätzen auslösen. In ihrer in der Fachzeitschrift Neuron veröffentlichten Studie gelang den Wissenschaftlern nun der Nachweis, dass ein spezifischer Regulator des Zellskeletts, alpha-2-Chimaerin, für die Fortleitung des von EphrinB3 ausgelösten Kollaps-Signals verantwortlich ist. Durch EphrinB3 aktivierte EphA4-Rezeptoren stimulieren alpha-2-Chimaerin. Diese Aktivierung führt über einen weiteren Signalschritt zur Hemmung eines Enzyms, das für die Stabilität des Zellskeletts verantwortlich ist, und leitet so den Kollaps auswachsender Nervenzellfortsätze ein. Bei Mäusen, die auf Grund einer gezielten genetischen Manipulation kein alpha-2-Chimaerin herstellen können, ist dieser Prozess ausgeschaltet. Die Folge: eine Fehlverschaltung des für die Steuerung der Laufbewegung verantwortlichen zentralen Mustergenerators. Die genetisch veränderten Mäuse aktivieren ihre Vorder- und Hinterbeine parallel - und hoppeln wie Kaninchen.
Mögliche Therapie bei Lähmungen
Ähnlich wie bei Mäusen werden auch die Laufbewegungen des Menschen durch zentrale Mustergeneratoren im Rückenmark gesteuert. Diese werden wahrscheinlich nach ähnlichen Prinzipien verschaltet, wie sie nun bei Mäusen entschlüsselt wurden. Die Erkenntnisse der Göttinger und Martinsrieder Wissenschaftler geben deshalb Anlass zur Hoffnung, dass bestimmte Lähmungen in Zukunft durch Manipulationen des neu entdeckten Signalwegs behandelt werden können.
Originalveröffentlichung: Wegmeyer, H., Egea, J., Rabe, N., Gezelius, H., Filosa, A., Enjin, A., Varoqueaux, F., Deininger, K., Schnütgen, F., Brose, N., Klein, R., Kullander, K. und Betz, A.; "EphA4-dependent axon guidance is mediated by the RacGAP alpha-2-Chimaerin"; Neuron 2007, 55, 756-767.
























































